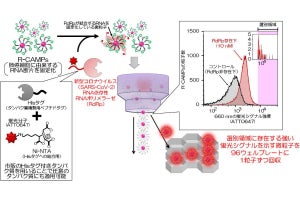
今回の研究では、まず実際の患者の生理的環境を再現した大腸がんモデルが樹立された。続いて、このモデルによってできた大腸がんの解析を、1細胞RNA-seq法を用いて行ったという。すると、Lgr5を強く発現しているがん幹細胞の中に、2つの亜集団が存在していることが確認されたとする。
-
(上)p57発現細胞の除去は、大腸がんの再発を抑制する。(下)1細胞RNA-seq法によって明らかにされた大腸がん細胞の組成。がん細胞の中には、A~Eの5種類の細胞が存在していることが明らかになった。このうちEは、Lgr5高発現がん幹細胞の亜集団で、p57の発現が高いことがわかる(出所:九大プレスリリースPDF)
そのうち一方は増殖の速い集団であるのに対し、もう一方は増殖の遅い(休眠状態)集団であり、抗がん剤への感受性が異なることが予想された。そして、後者の休眠状態のがん幹細胞には「p57遺伝子」が特異的に発現していることが確認され、この集団の鋭敏なマーカーとして使えることが明らかにされた。
p57発現細胞は休眠状態にあるため、抗がん剤治療などを受けていない通常の状態だと、がんの成長にはそれほど寄与しない。しかし、ひとたび抗がん剤治療を受けたあとには、がん再発の主役として登場するという。増殖の速い細胞が死んでしまう中、休眠状態のp57発現細胞は治療を生き延び、その後に休眠から覚めて増殖を開始するのである。つまり、いくら抗がん剤治療を受けても、p57発現細胞を退治できない限り、がんは何度でも再発してしまうことになる。
そこで研究チームは、特殊な遺伝子の仕掛けと薬剤を用いて、がん内のp57発現細胞を除去し、従来の治療と比較したという。抗がん剤治療だけだと、がんの大きさは無治療と比べて小さくなるものの、やはり再発が起きてしまう。しかし、抗がん剤治療とp57発現細胞除去治療を組み合わせた結果、再発を強力に抑えられることが確かめられた。この結果は、p57発現細胞ががん治療後再発の主要な原因であることを証明する知見だとしている。
-
p57発現細胞除去の治療効果。特殊な仕掛けを使って、がんが光るようにされている。抗がん剤とp57発現細胞を除く治療を組み合わせると、再発を強力に抑えられることがわかる(出所:九大プレスリリースPDF)
p57は細胞周期の停止に重要な遺伝子で、細胞増殖の強力なブレーキとして働くことが知られている。つまりp57は、がん幹細胞に特異的に発現することで、単にそのマーカーとして有用なだけでなく、同細胞の重要なアイデンティティである休眠状態の維持に直接寄与していると考えられるという。休眠状態によって抗がん剤への抵抗性がもたらされることを考えれば、p57の分子機能を阻害することで、がん幹細胞は休眠から目覚め、抗がん剤によって根絶可能になることが期待されるとした。
研究チームは今後、さらにp57発現細胞の研究を発展させることで、従来の抗がん剤治療だけでは不可能だった「がんの根治」を実現させることをを目指して、研究を進めていきたいと考えているとした。