具体的には、活性化型Ras変異体を発現する変異細胞と正常上皮細胞が1:50の比率で混合培養され、細胞競合が惹起させられたところ、混合培養された変異細胞内の細胞質成分や、細胞内小器官を包み込んだ二重膜構造体「オートファゴソーム」の数が、単独培養時に比べて増加することが確認されたとする。また、オートファゴソームの分解を阻害してもオートファゴソーム数に変化はなかったことから、正常細胞に囲まれたRas変異細胞ではautophagic fluxが停滞することが示唆されたという。
そこで、オートファゴソームと融合することで細胞内消化を担う小器官「リソソーム」の機能が検討されたところ、細胞競合下でのRas変異細胞ではリソソームの機能が著しく低下することが見出されたとする。
また、リソソームの機能を人為的に回復させると、オートファゴソームの蓄積が緩和され、さらには変異細胞の管腔側への排除率が有意に低下した。オートファゴソームの形成を阻害しても同様に細胞競合の効率が低下したことから、オートファゴソームは形成される必要はあるが必ずしも分解されない、すなわちその非分解機能が細胞競合を正に制御することが判明したとする。
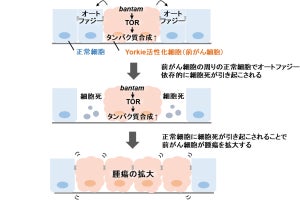
さらに、リソソームの機能低下ならびにオートファゴソームが蓄積する要因を調べるため、変異細胞に隣接する正常細胞による物理的排除圧の影響を検討。正常細胞内のフィラミンが変異細胞との境界面に集積し、これが変異細胞を管腔側へと押し上げる駆動力となることが、これまでの研究で判明していることから、正常細胞のフィラミンの機能阻害が行われたところ、変異細胞内のリソソームの機能低下とオートファゴソームの蓄積が観察されず、そのことから正常細胞からの物理的刺激が変異細胞内のオートファゴソームにおける分解異常の要因であることが明らかにされたという。
加えて、オートファゴソームの形成が不全なRas変異細胞と正常細胞とを混合培養すると、正常細胞のフィラミン集積が阻害されたことから、変異細胞内に蓄積されたオートファゴソームが隣接する正常細胞のフィラミン集積を誘導し、さらにこのフィラミン集積が変異細胞のオートファゴソームの分解異常を促進するといった、ポジティブフィードバック機構が細胞競合を制御することが見出されたという。
このほか、生体内の細胞競合におけるオートファジーの役割を評価することを目的に、マウス上皮細胞層に活性化Ras変異細胞を少数産生することが可能な細胞競合マウスモデル用いた実験を実施。同マウスのRas変異細胞のみでオートファゴソームの形成阻害がなされたところ、Ras変異誘導3日後の膵管において、Ras変異細胞の管腔への排除率が有意に低下したとする。また、Ras変異誘導から14日経過すると、膵臓の水腫や胃や脾臓との癒着が認められたとするほか、膵管内には変異細胞が堆積し、膵管構造が破綻しており、周辺では炎症性細胞が蓄積していたことも確認。これらの結果より、オートファジーが不全になると細胞競合の効率が低下し、変異細胞が蓄積した結果、慢性膵炎様病変を引き起こすことが確かめられたとする。
-
細胞競合におけるオートファジーの役割。正常細胞のフィラミン集積が変異細胞内のリソソーム機能低下ならびにオートファジー小胞の蓄積を誘引し、さらに蓄積したオートファジー小胞が正常細胞のフィラミン集積を促す (出所:理科大Webサイト)
なお研究チームでは、現在、オートファジーを標的とした抗がん剤開発が世界中で精力的に行われているが、今回の研究から、がんの進行段階によってオートファジーの役割が異なることが明らかになったことを踏まえ、がんの進行時期を考慮した制がん戦略が今後は必要になると思われるとしている。