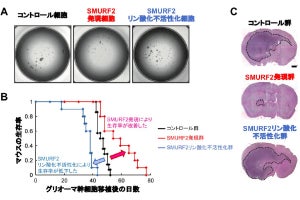
具体的には、今回の研究では、ASCが骨髄由来間葉系幹細胞と比較して致死性重症腎炎を改善させることが見出され、その作用機序について、投与したASCの生体内動態から解明が行われた。
その結果、ASCは腎障害を改善させたが、腎臓にはASCそのものはほとんど存在せず、脾臓に多く存在していることが判明。そこで、脾臓を介してASCが治療効果を発揮しているのかどうかを解明するために、脾臓を摘出した後にASCを投与し、腎炎に対する治療効果の評価が行われたところ、摘出後、ASCの腎炎に対する治療効果が消失し、腎臓における制御性T細胞の誘導も消失することが見出されたとする。
一方、腎臓において標識したASCの細胞膜成分は、ASCそのものではなく、ASC由来の細胞外小胞(EVs)の形で存在することがフローサイトメトリー解析と、高解像度顕微鏡により明らかにされた。EVsは最近注目を集める細胞間コミュニケーションツールであり、細胞が自分の細胞成分を細胞のかけらに包んで相手の細胞へ受け渡しているというもの。これにより、ある1つのタンパク質だけでなく、複数のタンパク質を複合的に同時に受け渡すことが可能となるという。
-
今回の研究の概要。秘蔵へ到達したASCがEVsを放出し、そのEVsが免疫制御マクロファージへ特異的に移送される。EVsの移送により、マクロファージの免疫制御機能が強化され、マクロファージは脾臓から循環血中へ入り腎臓へ到達することで、腎臓の修復に寄与した (出所:名大プレスリリースPDF)
今回の研究では、脾臓へ到達したASCがEVsを放出し、そのEVsが免疫制御マクロファージへ特異的に移送されることが見出されたほか、EVsの移送によりマクロファージの免疫制御機能が強化され、同マクロファージは脾臓から循環血中へ入り腎臓へ到達することで、腎臓の修復に寄与していることを最新のイメージング技術・細胞機能解析から判明したとする。
また、投与したASCが生体内で分泌したEVsの検出に成功したことで、生体内で産生されたASC由来EVsが免疫制御マクロファージに誘導した機能的変化を次世代シーケンサーによるRNAシークエンス解析から明らかにされたともする。
脂肪は骨髄に比較して採取が容易であり、その優れた増殖能からASCが注目されている。今回の研究で、骨髄由来間葉系幹細胞よりもASCが高い免疫調整能・臓器保護能を有することが見出されたことから研究チームでは今後、腎炎以外にもさまざまな難治性炎症疾患に対する新規治療法として、臨床応用を行っていきたいとしている。また、今回の研究で解明されたASCの作用機序を、治療効果をより高めた新規治療法へと応用し、さらには細胞そのものを直接投与しないEVsを用いた革新的治療法へ発展させていくとしている。