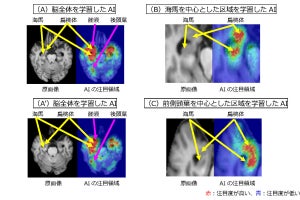
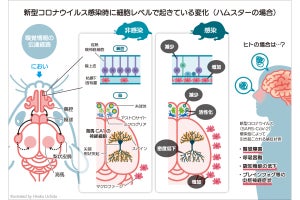
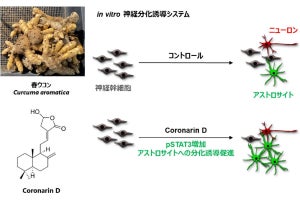
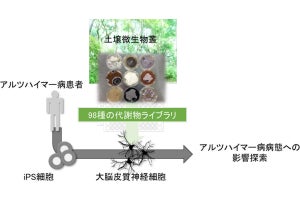
脳では、アストロサイトがアンモニアを利用することが知られていることから、今回の研究ではまず、ラットの脳からアストロサイトが分離培養され、アンモニア刺激を行ったところ、APPの発現上昇が観察されたという。
また、アンモニアは一般に細胞内のpHを上昇させることで、タンパク質分解を阻害することも知られていることから、培養液中のpHを上昇させて細胞内のAPPの発現量が検討されたものの変化はなかったが、アンモニアの成分自体がAPPの発現量を上昇させることが確認されたとするほか、発現が上昇しているAPPは、細胞内で成熟した成熟APPであり、修飾が未熟で機能を持っていない未成熟APPの発現量には変化がないことも判明したという。
APPは細胞膜に発現して機能する膜タンパク質であり、アンモニア刺激後のAPPの局在を観察したところ、細胞内に移動していることが判明。通常、細胞内に入り込んだ膜タンパク質はリソソームに運搬されて分解されるが、APPはリソソームではなく、主に小胞体に運搬されていることが判明したという。
これらの結果を踏まえ研究チームでは、アンモニア刺激後のアストロサイトの小胞体でアミロイドβが産生されるかの検討を実施。その結果、凝集性の高いAβ42のみ、産生が著しく上昇していることが確かめられたとする。Aβ42の産生はほとんど小胞体でのみ観察されたほか、APPの細胞膜から細胞内への移動を阻害すると小胞体内でのAβ42は観察されないことも判明し、このAβ42は細胞膜上の成熟APPから産生されたものであることが判明したとする。
さらに、培養アストロサイトで得られた研究結果をモデル動物でも検討することを目的に高アンモニア血症マウスが作成され、脳内のAPPとAβの観察を行ったところ、アストロサイトの炎症反応や神経変性が観察され、アストロサイト内でのAPPとAβの発現上昇が認められたとする。このことから、高アンモニア血症を発症すると、アンモニアによるAβ産生が亢進し、ADの発症につながる可能性があることが判明したと研究チームでは説明している。
これまでもAD患者の脳で、アストロサイト内にAβは観察されていた。しかし、それらは神経細胞が産生したAβをアストロサイトが貪食したものであると考えられてきたという。しかし、今回の研究からは、まったく新しい、アストロサイトによるAβの産生メカニズムが示されたこととなる。
また今回の研究から、高アンモニア血症がアストロサイトでのAβ産生を促進させることも確認されたことについて研究チームでは、これまで神経細胞による産生が注目されてきたAβだが、アストロサイトでも産生されること、さらにはその過程が小胞体へのAPPの運搬によることが明らかになったことから、AD治療の新規標的になることが期待されるとしている。