京都大学(京大)は9月18日、脳の皮質のニューロン(神経細胞)内で細胞核が、核膜分子の「Nesprin-2(ネスプリン2)」によって、「キネシン」と「ダイニン」という2種類のモータータンパク質が協調することで輸送される機構などを明らかにしたことを発表した。
同成果は、京大 高等研究院 物質―細胞統合システム拠点(iCeMS)の見學美根子教授、同・大学大学院 生命科学研究科のジョウ・チュウイン大学院生/学術振興会特別研究員、iCeMSの呉攸研究員(現・博士)、同・藤原敬宏特定准教授、同・石舘文善客員教授らの研究チームによるもの。詳細は、細胞生物学に関する全般を扱う学術誌「Journal of Cell Biology」に掲載された。
ヒトの脳にはおよそ860億個のニューロンが存在し、精緻な神経回路ネットワークが形成されている。脳の発生中に分裂層に集積している幹細胞から誕生したニューロンは、順番に移動して秩序正しく配置し皮質を構築する。この時、細胞の核も細胞骨格である「微小管」(直径数十nmの環状構造で、チューブリンという数nmのタンパク質が連結して形成され、重合と脱重合により伸縮する)をレールとして移動方向へと運ばれていく。重篤な脳奇形を伴う疾患である「I型滑脳症」は、核の微小管輸送の異常によることが知られている。
微小管輸送は、細胞内における最も重要な物流システム。モータータンパク質として知られるキネシンとダイニンが、それぞれ微小管の+端と-端へ、数nmの分子から数マイクロメートルの細胞内小器官まで、大小さまざまな積荷を輸送する仕組みである。しかし、両タンパク質がどのように協調して、積荷を目的地に正確に届けるのかはこれまでのところ解明されていないという。ニューロンでは、核は専らダイニンと結合して「中心体」に収束する微小管-端へ移動すると考えられてきた。しかし、核周辺の微小管は必ずしも中心体に収束しておらず、中心体の位置も安定しないため、このモデルが正しいのか、まだ疑問が残っていたという。そこで研究チームは今回、核と微小管モーターを連結させるアダプター分子として、小脳ニューロンに高発現する核膜分子であるNesprin-2に注目することにしたとする。
ニューロンでNesprin-2が欠損させられたところ、核輸送が停滞して脳皮質が正常に形成されないことが判明し、同分子が核輸送に重要であることが見出されたとした。同分子はダイニンにもキネシンにも結合する活性を持ち、人工的な積荷を同分子と結合させると、両タンパク質に結合して微小管上を往復することが確認されたという。同分子に結合した両タンパク質は、綱引きするように競い合うのではなく、お互いのモーター活性を高め合う効果を有しており、単独で結合した時よりも積荷を動かす能力が高まっていることがわかったとした。
-
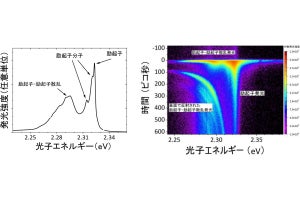
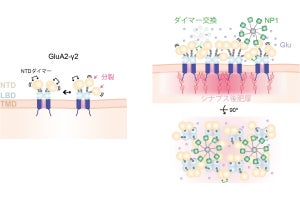
ニューロン内での核輸送。核はNesprin-2を介してキネシンとダイニンと結合し、微小管上を往復運動する。周囲の微小管はニューロンの進行方向へ流れており、核は微小管と着脱を繰り返して動きながら、微小管と共に前進する(出所:iCeMSプレスリリースPDF)
また、キネシンに結合できないNesprin-2変異分子を発現させたニューロンでは、ダイニンによる輸送活性も低下して核輸送が停滞することが確認された。さらに、Nesprin-2はダイニンとキネシンを協調させ、核周辺の微小管を乗り換えながら核を動かし続けるが、核の進行方向は規定しないことも突き止められた。以上のことから、核がダイニンのみと結合して一方向へ動くというこれまでの解釈が誤りであることを意味するとした。
次に、なぜ細胞内で核が一方向へ前進できるのかが調べられた。その結果、ニューロンでは微小管自体が細胞内をスライドするように前進しており、微小管ネットワークごと核が移動することが明らかにされたという。なお、微小管が前進するメカニズムはまだ不明で、現在研究中とした。
研究チームは、核が微小管を往復しながら動き続けることは、狭い組織空間を大きな核がすり抜けるのに有効だと考えているとする。細胞には、核特異的なNesprin以外に、オルガネラなどの積荷ごとに微小管アダプター分子が多数存在し、そのアダプター分子の機能によって、積荷の大きさや輸送距離に合わせたモーターの連携や輸送方法が選ばれていることが考えられるとしている。
ニューロンの核輸送の異常は先天性の脳奇形の原因となるほか、統合失調症との関係も確認されている。今回の研究成果は、それらの疾患の病因や病態の理解、治療法の開発につながる可能性があるという。また、モータータンパク質を制御して細胞内の標的に分子を運ぶナノロボットを開発し、細胞変性の原因となる異常分子や感染ウイルスに直接薬剤を投与することができるようになる可能性もあるとしている。