明治薬科大(明薬大)と京都薬科大学(京薬大)の両者は8月23日、これまではほ乳類などの真核細胞の培養細胞を用いているために開発・製造コストが高騰していたバイオ医薬品の製剤において、コストの削減を実現できる細菌を用いた発現系での課題だった、少量でも強力な炎症誘導活性を有するグラム陰性菌の細胞壁構成成分「エンドトキシン」の混入を解決した新規タンパク質発現システムを開発し、機能的な低分子抗体の生産に成功したことを発表した。
同成果は、明薬大の鴨志田剛講師、同・森田雄二教授、京薬大の八尋錦之助教授らの研究チームによるもの。詳細は、米国科学アカデミー紀要「PNAS」の姉妹誌で科学の幅広い分野を扱う学術誌「PNAS Nexus」に掲載された。
近年、バイオ医薬品が技術的な革新を遂げているが、バイオ医薬品の製剤にはほ乳類などの真核細胞の培養細胞を用いるため、開発・製造コストが高騰しており、その結果、医療費の高騰を招いてしまっているという。それに対し、細菌を用いた発現系は培養細胞よりはるかに安価であることから、バイオ医薬品の薬価低減を目指す上で極めて有用とする。しかし、細菌を用いたバイオ医薬品生産の最大障壁となるのが、少量でも強力な炎症誘導活性を有するエンドトキシンの混入の問題だ。エンドトキシンは、グラム陰性菌の細胞壁構成成分のリポ多糖の一種で、「内毒素」とも呼ばれる代表的な発熱物質だ。そのためこの問題を解決する安全で安価なバイオ医薬品の生産システムの開発が求められていた。
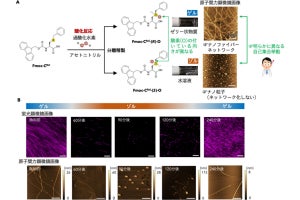
グラム陰性細菌は本来、生存するためにはエンドトキシンを必須とするが、それを完全に欠損しても生存可能であるというとても風変わりな特性を有するのが、「Acinetobacter baumannii」だ。実際、同菌株のエンドトキシン量をカブトガニの血球抽出成分を用いて高感度に検出する「LALアッセイ法」で測定したところ、0.03EU/mL(OD600 0.1)と非常に低い値だったとのこと(飲料水の100分の1~500分の1)。そこで研究チームは今回、エンドトキシン欠損A.baumanniiを組み換えタンパク質発現宿主として利用すれば、エンドトキシン汚染を完全に排除できる可能性を着想したという。
まず、すでにエンドトキシン汚染を軽減した大腸菌株として販売されている「ClearColi」と比較しつつ、緑色蛍光タンパク質(GFP)の精製が試みられた。その結果、機能的かつエンドトキシン汚染を従来法(ClearColiを宿主に使用)から約3桁も減少させることに成功したとする。
近年、細菌でも生産可能なラクダ科動物の重鎖抗体の可変部である「VHH抗体」をはじめとした低分子抗体が、新規創薬モダリティとして注目されているが、研究チームで構築したシステムを用いても、そうした低分子抗体の発現は通常では困難な状況だという。そこで今回の研究では、A.baumanniiの「Omp38」(グラム陰性菌の外膜に存在する膜輸送タンパク質)の「ペリプラズム」(グラム陰性菌の外膜と内膜の間の領域)への移行シグナル(ペリプラズムにタンパク質を発現させるためのシグナル)を、発現タンパク質に導入。その結果、VHH抗体の菌体外生産が実現されたとした。
それにより、機能的でエンドトキシン混入量の極めて少ない、新型コロナウイルス(SARS-CoV-2)のスパイクタンパク質に特異的に結合するVHH抗体(0.26EU/mg)および、2022年に関節リウマチに対する国内初のVHH抗体製剤として承認された「オゾラリズマブ」(0.99EU/mg)を培養上清から精製することに成功したという。オゾラリズマブは30mgを皮下投与で用いられるため、今回の研究では粗精製品にも関わらず、各国薬局方が定める1時間あたり5EU/kg以下に十分適合しているとする。
以上のことから研究チームは、細菌を用いても安全にバイオ医薬品を生産できる新規組み換えタンパク質発現システムを構築できたとする。そして今回の研究成果は、高騰する医療費の削減につながることが期待できるとしている。