神戸大学と徳島大学は7月11日、運動時のエネルギー消費をコントロールするタンパク質の機能を解明し、同じ運動量でも痩せやすさに個人差がある理由を解明したと共同で発表した。
同成果は、神戸大大学院 医学研究科 糖尿病・内分泌内科学部門の小川渉教授、徳島大大学院 医歯薬学研究部 代謝栄養学分野の野村和弘講師らの研究チームによるもの。詳細は、代謝に関する全般を扱う学術誌「Molecular Metabolism」に掲載された。
-
研究の概要図。運動すると体重が減るメカニズム。運動をすると筋肉がエネルギーを消費するため、脂肪が燃やされ、体重が減少。運動時には、筋肉でPGC-1αbとPGC-1αcというタンパク質が増え、それによりエネルギー消費が高まり脂肪を燃焼させることが判明。両タンパク質が増えにくい人は、運動時のエネルギー消費が少ないことも解明された(出所:神戸大Webサイト)
運動をすると筋肉が多くのエネルギーを消費するため、脂肪がエネルギー源として燃やされ、それが体重の減少につながる。その時、筋肉ではエネルギー消費を増やすいくつもの遺伝子の発現が増加することがわかっている。しかし、同じだけの運動を行っても痩せやすい人と痩せにくい人がおり、そのメカニズムはよくわかっていなかったという。
転写因子「PPARγ」に結合する転写コアクチベーターとして同定されたタンパク質の「ペルオキシソーム増殖因子活性化レセプターγ共役因子」(PGC-1α)が、痩せやすさ・太りやすさと関係する可能性が指摘されていた。しかし、マウスを使った動物実験で、PGC-1αを欠損させたからといって太りやすくなるわけではないという報告や、同タンパク質を強制的に多く発現させても痩せやすくなることはないという報告もなされていた。そのため、PGC-1αが痩せやすさ・太りやすさと関係するという仮説には、疑問が投げかけられていたとする。
-
運動による骨格筋でのPGC-1αの発現変化。マウスに運動負荷あり・なしの条件で骨格筋を採取し、PGC-1αの発現量が検討された。運動すると、骨格筋ではPGC-1αbとPGC-1αcの発現が増えるが、従来型のPGC-1αaの発現は増えない(出所:神戸大Webサイト)
そうした中、PGC-1α遺伝子から作られるタンパク質に、「PGC-1αb」および「PGC-1αc」の2種類があることを発見したのが、神戸大の小川教授らの研究チームだ。これらの新規PGC-1αは、従来のPGC-1α(PGC-1αa)と比較して、遺伝子発現誘導能や転写活性化能などのタンパク質としての機能はほぼ同じだが、発現制御のメカニズムが異なり、運動によって筋肉での発現が10倍以上に増加するという。その一方で、従来のPGC-1αは運動によって発現がそれほど増えることはなかったとする。そこで研究チームは今回、従来のPGC-1αの量には影響を及ぼさず、新規PGC-1αだけを欠損させたノックアウトマウスを遺伝子操作で作出し、運動時のエネルギー消費に関する分析を行うことにしたという。
-
PGC-1αbとPGC-1αcを無くした遺伝子改変マウスの、運動によるエネルギー消費量と体重減少の減弱。野生型マウスとPGC-1αbとPGC-1αcノックアウトマウスのトレッドミル運動中のエネルギー消費量(左)と、運動による脂肪量の減少(右)。新規PGC-1αを無くしたマウスは運動させてもエネルギー消費が少なく(左)、脂肪量も減少しにくかった(右)(出所:神戸大Webサイト)
分析の結果、新規PGC-1αだけを欠損させたノックアウトマウスは、運動時のエネルギー消費の増強が妨げられ、運動させても体重が減りにくいことが判明。また、同マウスを長期間飼育すると、日常のエネルギー消費が抑制されるため、次第に太っていくことも明らかにされた。
-
PGC-1αbとPGC-1αcノックアウトマウスの体重の変化。同ノックアウトマウスを長く飼育していると、日常のエネルギー消費が抑制されるため、次第に太っていく(左)。16週齢マウスの腹部CT像(右)。ノックアウトマウスでは紫色で表される内臓脂肪が多い(出所:神戸大Webサイト)
また新規PGC-1αは、「褐色脂肪組織」での脂肪燃焼や熱産生にも重要な働きをすることも突き止められたという。動物は寒い環境では褐色脂肪組織の熱産生が増えて体温を保とうとするが、新規PGC-1αのノックアウトマウスは寒い環境で体温を保つことができなかったとした。褐色脂肪組織の脂肪燃焼減弱や熱産生低下も、このマウスの太りやすさと関係する可能性があるとする。なお脂肪組織には、主な機能が脂肪の蓄積である白色脂肪組織と、脂肪の燃焼である褐色脂肪組織の2種類が存在する。
-
寒冷刺激による褐色脂肪組織でのPGC-1αの発現変化と、PGC-1αbおよびPGC-1αcノックアウトマウスの体温の変化。マウスに寒冷刺激、あり・無しの条件で褐色脂肪組織が採取され、PGC-1αの発現量が検討された。寒い環境(4℃)では褐色脂肪組織でPGC-1αbとPGC-1αcの発現が増えるが、PGC-1αaの発現は増えない(左)。また、新規PGC-1αノックアウトマウスは寒い環境で体温を保つことができない(右)(出所:神戸大Webサイト)
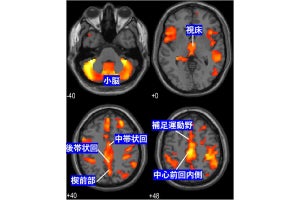
ヒトにもこの新規PGC-1αは存在し、マウスと同様に運動をすると筋肉でこのタンパク質の発現が10倍以上増えることが確認された。運動による新規PGC-1αの増え方には個人差があり、新規PGC-1αの増え方が大きい人はエネルギー消費が高く、増え方が小さい人はエネルギー消費が低いことも解明された。同じ量の運動をしても、エネルギー消費が多い人(つまり痩せやすい人)と、エネルギー消費が少ない人(痩せにくい人)がいるが、新規PGC-1αの増えやすさはこのような個人の体質を決める要因の1つであることが考えられるとした。
-
骨格筋におけるPGC-1αの発現変化とエネルギー消費量の関係。運動による新規PGC-1αの増え方には個人差があるが、PGC-1αの増え方が大きい人はエネルギー消費が多く、増え方が小さい人はエネルギー消費が少ない(出所:神戸大Webサイト)
PGC-1αは、運動時のエネルギー消費を制御する機能を持つ可能性が示唆されていたが、今回の研究で、実際にそのような作用を持つのは以前から知られていたPGC-1αではなく、新規PGC-1αであることが明らかとなった。
肥満はエネルギーの摂取と消費のバランスの乱れによって起こる。最近では、食欲を抑制してエネルギーの摂取を減らす肥満症治療薬が開発され、世界で広く使われ始めているが、エネルギーの消費を高めて肥満を治療する薬剤はない。
新規PGC-1αを増やせる物質を発見できれば、運動時のエネルギー消費をより高める薬(運動効果増強薬)、さらには運動しなくても運動時と同様にエネルギー消費を強める薬(運動効果模倣薬)の開発につながる可能性があるという。このような薬剤は、食事制限と無関係に肥満を治療できる薬剤になると思われ、そのニーズは極めて高いことが考えられるとしている。