東京大学(東大)は4月17日、通常の光学顕微鏡では捉えられない分子振動の空間分布を捉えられる中赤外顕微鏡において、新技術を用いて光の回折限界という原理的な限界を超える約120nmの空間分解能を達成し、細菌内部の生体分子の分布を観察することに成功したと発表した。
同成果は、東大大学院 理学系研究科附属 フォトンサイエンス研究機構の玉光未侑特任研究員(研究当時)、同・戸田圭一郎特任研究員、東大大学院 理学系研究科 物理学専攻の福島誠人大学院生、東大大学院 理学系研究科附属 フォトンサイエンス研究機構の井手口拓郎准教授らの研究チームによるもの。詳細は、英科学誌「Nature」系の光学に関する全般を扱う学術誌「Nature Photonics」に掲載された。
赤外線はおよそ780~10万nmという幅広い波長域を持つ光(電磁波)のため、可視光の赤に接する近赤外線から電波に近い遠赤外線まで、一般的には3種類に細分化されている。2500~2万5000nmの波長域は中赤外線(単に赤外線といわれることも)と呼ばれ、中赤外顕微鏡は近赤外の一部を含む、2000~2万nm程度の主に中赤外線の波長域で観察できる顕微鏡だ。特徴は、非破壊、非標識、非接触で物質の分子組成の空間分布を観察できる点で、課題は、空間分解能が数千nmと低い点。顕微鏡の空間分解能は光の回折限界で決まるため、扱う光の波長が長くなるほど空間分解能が低くなるという宿命を持つ。
そうした中、井手口准教授らが2023年7月に、従来技術の空間分解能の限界を突破する「中赤外フォトサーマル顕微鏡」を発表。同顕微鏡は、中赤外光の吸収によって発生する熱による屈折率の変化を可視光の顕微鏡で検出することで、中赤外光の回折限界以下の空間分解能を実現するという手法だ。そこで今回の研究では、中赤外フォトサーマル顕微鏡に新たな技術を導入し、さらに高い空間分解能を目指すことにしたという。
-
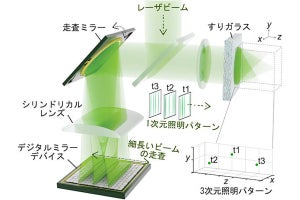
(a)単一の対物レンズを用いた中赤外フォトサーマル顕微鏡。中赤外光を透過する一方で可視光を反射するシリコン基板上に試料を置くことにより、単一の対物レンズで開口合成を用いた中赤外フォトサーマル顕微鏡の実装が可能となった。(b)開口合成法の概略。異なる照明角度により広い空間周波数成分の情報を得ることで、高い空間分解能を得られる。(c)ナノ秒以下のパルス幅を持つ中赤外光パルスおよび可視光パルスを用いることで、中赤外フォトサーマル効果で生じた熱が広く拡散する前に計測を行うことが可能 (出所:東大Webサイト)
従来の中赤外フォトサーマル顕微鏡では、(1)「用いている対物レンズの開口数の低さ」と、(2)「パルス幅の長い中赤外光により生じる熱拡散」という2つの原因により空間分解能が制限されていたとする。そこで今回は、高い開口数を持つ対物レンズを用いて高空間分解イメージングを実現する「開口合成法」を用いることで(1)の問題を解決。また、ナノ秒以下のパルス幅を持つ中赤外パルス光源を開発することで、(2)の問題を解決することに成功。約120nmの空間分解能が達成され、細菌内部のタンパク質や脂質といった生体分子の分布を非標識で可視化し、定量することができたとした。
しかも、空間分解能はこれが限界ではないとし、可視光の波長と対物レンズの開口数を最適化することで、さらに100nm以下の分解能へと改善できる余地があるとしている。
-
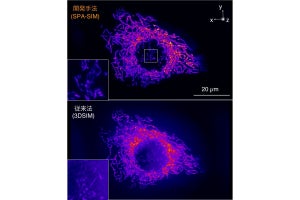
高空間分解能中赤外フォトサーマル顕微鏡によるバクテリアのスペクトルイメージング解析。(a~c)Escherichia coli(大腸菌)と(d~f)Rhodococcus jostii RHA1の(a・d)位相画像、(b・e)2920、(c・f)3000cm-1での中赤外フォトサーマル画像。R.jostii RHA1では2つのフォトサーマル画像(e・f)の間で信号の空間分布が大きく変わっているが、E.coli(b・c)では大きな違いが見られないことから、2種類のバクテリアの間で細胞内の主要な分子種に違いがあることが推察される。特に、R.jostii RHA1では、2920cm-1での中赤外フォトサーマル画像(e)に脂質玉と考えられる微小構造が確認できる (出所:東大Webサイト)
従来のマイクロスコピーからナノスコピー(100nm以下の空間分解能を有する顕微鏡観測)へと進化した中赤外顕微鏡技術は、微細な構造を持つ物質の分子振動の分布を非破壊、非標識、非接触で分析することを可能にし、生物学、医学、材料工学などの分野での幅広い利用が期待されるとしている。