名古屋大学(名大)は4月10日、飲酒時の顔面紅潮や吐き気などの原因物質となる「アセトアルデヒド」など、「アルデヒド」の仲間によって受けたDNAの傷が素早く治される仕組みを解明することで、遺伝性早老症や老化の原因の一端を解明したと発表した。
同成果は、名大 環境医学研究所 発生遺伝分野の岡泰由講師、同・中沢由華講師、同・嶋田繭子技術員、同・荻朋男教授らの研究チームによるもの。詳細は、細胞生物学に関する全般を扱う学術誌「Nature Cell Biology」に掲載された。
最も単純なアルデヒドである「ホルムアルデヒド(ホルマリン)」は、発がん性物質に分類されており、細胞内の一般的な代謝反応でも生じるため、速やかに解毒する必要がある。
血液症状を中心に、小児期より早期老化症状を示す遺伝背性疾患「AMeD症候群」では、アルデヒド脱水素(解毒代謝)酵素「ALDH2」と、アルコール脱水素酵素「ADH5」が、十分に働かないことが疾患の引き金になることが予想されていた。しかし、さまざまな病態の成り立ちを説明できていなかったという。そこで研究チームは今回、ホルムアルデヒドによって生じるDNA損傷の修復分子メカニズムを理解することで、AMeD症候群を含む早期老化疾患の病態の解明を目指すことにしたとする。
今回の研究では、ホルムアルデヒドによって生じる、DNAとタンパク質が結合したDNA損傷の「DPC」が着目された。DPCがゲノム全体でどのように修復されるのかは未解明で、その解析方法もなかったという。そこで、次世代シーケンス解析を駆使した新たな実験方法「DPC-seq」が開発された。
-
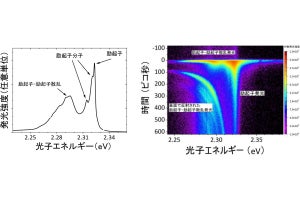
転写領域でのDPC修復。ホルムアルデヒドを処理した細胞からDPCを単離・精製した後に、ハイスループットシーケンス解析が実施された。得られたDPCリードがマッピングされ、ゲノムビューアを用いて視覚化された。転写が活発な遺伝子領域では、DPCが修復されている(出所:名大プレスリリースPDF)
DPC-seqの結果、ホルムアルデヒドによって生じたDPCの修復が、遺伝子の転写が活発な領域で優先的に行われていることが判明したという。DPCが存在すると、RNAポリメラーゼによる転写が阻害されてしまう。そこで、転写が活発な領域でDPC修復に関与する因子を探索するため、細胞をホルムアルデヒドで処理し、転写ができなくなったRNAポリメラーゼに結合するタンパク質を、質量分析装置を用いたプロテオーム解析で網羅的に同定することにしたとする。その結果、成長障害、神経変性、日光過敏などを示す遺伝性早老症である「コケイン症候群」の発症に関わるタンパク質「CSB」が、RNAポリメラーゼと結合することが明らかにされた。
CSBは、紫外線によってできたDNA損傷の修復にも関与するが、その詳細な役割は不明だった。そこで、CSBの機能欠損細胞を用いてDPC-seqが実施され、転写領域のDPC修復が遅延することが確認されたという。さらに、DPC-seqとさまざまな阻害剤を組み合わせた実験により、タンパク質分解酵素「プロテアソーム」が転写領域でのDPC修復に関与することがわかった。
-
CSB依存的な転写共役型DPC修復。DPCリードをゲノムにマッピングしたmetageneプロット。コントロール細胞とCSB欠損細胞を比較した時、回復時間が0時間だと違いはないが、回復時間が4時間の場合、CSB欠損細胞では転写領域でのDPC修復が遅延している(出所:名大プレスリリースPDF)
DNAは細胞核内で、タンパク質「ヒストン」に巻き付くことで、コンパクトに収納されている。そこで、ホルムアルデヒドによってヒストンとDNAが結合してDPCを生じている(ヒストン-DPC)可能性が予想され、ヒストンを濃縮したサンプルを用いてDPC-seqが実施された。その結果、ヒストン-DPCがホルムアルデヒド処理によって生じること、その修復にCSBが関与することが確かめられた。
次に、アルデヒド分解能が低下しているAMeD症候群モデルマウスでは、ゲノムにDPCが蓄積している可能性が推察され、血液細胞のDPCが測定された。その結果、同マウスの血液細胞ではDPCが蓄積していること、さらに遺伝子の転写が活発な領域で優先的にDPCが修復されていることが明らかにされた。
最後に、転写領域でのDNA修復とアルデヒド分解能が低下したマウス(ALDH2、ADH5、CSBの3重機能欠損)の解析が行われた。すると、それぞれの単独機能欠損マウスと比較して3重機能欠損マウスでは、より重篤な個体表現型(短命、成長障害、造血不全)を示すことが判明。また、3重機能欠損マウスの血液細胞では、遺伝子の転写が活発な領域において、より多くのDPCが蓄積していたという。これらの結果から、AMeD症候群とコケイン症候群の症状の原因が、転写領域でのアルデヒド由来のDPC修復の過負荷(AMeD症候群)または欠損(コケイン症候群)と考えられるとした。
AMeD症候群やコケイン症候群では、疾患原因が完全には理解されていないため、治療薬の開発が進んでいない。今回の成果から、アルデヒドを除去する化合物を探索することで、将来的に治療薬候補を見つけられる可能性があることが期待されるとした。また今回の研究は、老化に関連したDNA損傷の一種として、アルデヒド由来DPCを提唱するものだという。個体の老化現象について、さらなる理解につながることが期待されるとしている。