量子科学技術研究開発機構(QST)は3月15日、骨軟部肉腫に対する「マルチイオン」を用いた重粒子線(放射線)がん治療を開始し、2023年11~12月に1例目の治療を実施したことを発表した。
同成果は、QST 治療診断部の今井礼子治療課長らの研究チームによるもの。
重粒子線がん治療は、手術・抗がん剤による化学療法と並び、がんの標準的な治療法の1つとして知られる(近年はそこに免疫療法も加わった)。同治療は、QSTの前身である放射線医学総合研究所によって1994年6月から開始され、2023年3月までに約1万5000人のがん患者に実施されたという(重粒子線がん治療が行える施設は世界に16施設しかなく、そのうちの7施設が日本にある)。
ヘリウム以上の原子番号を持つ原子核(重イオン)のビームのことを重粒子線といい、日本においては、これまで主に炭素イオン線が重粒子線がん治療に用いられてきた。炭素原子核は陽子(水素イオン)の12倍の重さを持ち、それを光速の約70%まで加速して照射することから、高い線量集中性と生物効果を持ち合わせ、がんや肉腫などの悪性腫瘍性疾患の治療に適しているという。
研究チームによると、手術非適応の骨軟部肉腫に対する重粒子線がん治療は、これまで良好な治療成績を収めてきたとのこと。しかしその一方で、約30%程度の局所再発例があった。これは、LET(放射線が細胞核サイズの局所に与えるエネルギー量の違いを表す数値)が低くなると、酸素濃度の低い細胞に対する殺細胞効果が低下するためだと考えられている。
LETが低くなる理由は、腫瘍の大きさにある。大きな腫瘍では、酸素濃度が低い部分が増える傾向があるため、高LET放射線である炭素イオン線でも、治療効果が低下してしまう可能性があるのだという。QSTの臨床研究でも、腫瘍径が大きい症例では再発率が高く、400cc以上の大きな腫瘍では部分的にLETが低くなりやすいことが明らかにされていた。
それらの理由から、腫瘍全体の線量だけでなくLETを高くすることにより、大きい腫瘍でも治療効果の向上を図れる可能性があると考察されてきた。しかし、炭素イオン線のみでLETを増加させるには物理的に限界があるという課題が残されていたとのこと。そこで、同イオン線に加え、より重くLETが高い酸素やネオンなど複数種のイオン線を照射すれば、正常な周辺組織のダメージを増やすことなく、腫瘍内のLETのみを増加させることができると考えられたという。
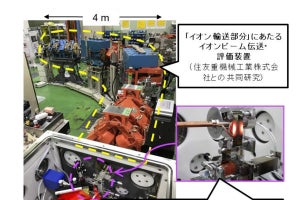
複数種のイオン線を用いて、腫瘍内の線量だけでなくLETの分布を制御するこの治療法は、QSTでは「マルチイオン治療」と呼ばれる。その研究開発を進めた結果、2022年には、住友重機械工業との共同研究により、ヘリウムからネオンまでの多価イオンを出力するマルチイオン源の開発に成功したとする。
また、腫瘍内の線量は炭素線のみの場合と同等に保ちながら、複数のイオン種でLETの分布を最適化するための計算技術の開発や、複数のイオン種を照射する制御技術の開発も行われてきた。そして今回、それらの技術の治療計画装置や照射制御装置への実装が完了し、さらに照射システムの品質保証方法の確立も進んだことで、マルチイオン治療を実施できる環境が整ったとのこと。そこで骨軟部肉腫に対し、腫瘍内の線量だけでなく、LETの分布を最適にするマルチイオン治療が安全かつ有効であることを臨床的に確認するため、臨床研究を開始したとしている。
今回の臨床研究は、「脊索腫」を除く、腫瘍の体積が400cc以上の骨軟部肉腫の10例に対して行われる。すでに実施された1例目は、4週間で計16回(4回/週)の照射が実施され、各回の治療は準備を含め約30分、そのうち照射時間は約15分だった。研究チームは、今回のように炭素イオン線と酸素イオン線を用いて同日に治療することは初めての試みだったものの、2種のイオン線の切り替えも順調だったとする。
なお、患者は治療終了翌日に無事に退院し、まもなく治療2か月となる中でも早期副作用はなく経過しているという。放射線による抗腫瘍効果は一般的に3か月の観察期間を経て評価されるため、今後は晩期放射線合併症と合わせて十分に留意して外来で慎重に経過を見ていく予定としている。
研究チームでは今後も、開発されたマルチイオン源を用いた骨軟部腫瘍に対するマルチイオン治療の臨床研究を進め、さらに膵臓がんや頭頸部腫瘍などの難治性疾患にも適用を拡大し治療成績の向上を図るという。
またQST千葉地区では2023年より、マルチイオン照射の実用化を目指し、マルチイオン源を備えた第4世代量子メス実証機を設置する量子メス棟(仮称)を建設中であることから、現在QST病院が用いている治療用重粒子線加速器、および今後完成する第4世代量子メス実証機でのマルチイオン治療の臨床実績を蓄積し、重粒子線がん治療の高度化と普及加速を目指すとしている。