慶應義塾大学(慶大)は11月22日、がん免疫療法のためにT細胞の遺伝子改変を効率的に行うため、2020年のノーベル化学賞受賞で知られるゲノム編集ツール「CRISPR/Cas9(クリスパー・キャスナイン)」を使って遺伝子を欠失させる際の、効率的な設計アルゴリズムの開発に成功したことを発表した。
同成果は、慶大 医学部 先端医科学研究所 がん免疫研究部門の籠谷勇紀教授、同・伊藤雄介専任講師、同・大学 医学部 石井・石橋記念講座(拡張知能医学)の石川哲朗准教授らの共同研究チームによるもの。詳細は、核酸の代謝や相互作用に関与する核酸およびタンパク質に関する全般を扱う学術誌「Nucleic Acids Research」に掲載された。
T細胞(Tリンパ球)のように、本来、ヒトの免疫システムにはがん細胞を攻撃する能力があるが、加齢などによって弱まったり(免疫老化)、ずる賢いがん細胞によって攻撃にブレーキをかけさせられてしまったりすると、がんを攻撃する力が弱まったり、攻撃できなくなってしまう。そのもともと持っている免疫力を高めて、がん細胞を攻撃させるのが「がん免疫療法」である。
がん免疫療法は、治療が難しいがんに有効な手法として注目されており、中でも「キメラ抗原受容体導入T細胞(CAR-T細胞)療法」は、T細胞を患者本人の血液から取り出し、人工遺伝子「CAR」を外から導入することで、がん細胞を攻撃できるように加工された薬を使う治療であり、一部の血液がんに対して高い効果が示されたことから、現在は保険診療においても用いられるようになっている。しかし、ほかのさまざまながんに対してはまだ十分な効果が確認されておらず、さらに効果を高めるためにT細胞の改造改良強化が望まれている。
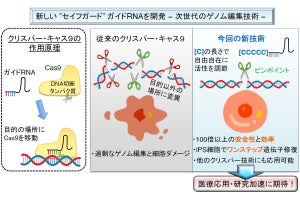
CAR-T細胞は、がんに対する攻撃を続ける中で、徐々に機能が落ちていく場合があるが、その際に特定の遺伝子が働いていることが明らかにされている。このことから、それらの遺伝子を欠失させることで、細胞の機能を長く保ち、治療効果を高められる可能性があるという。その際に有用な道具となるのが、遺伝子の特定の領域を狙って切断し、その遺伝子の機能を欠失させられるゲノム編集ツールCRISPR/Cas9である。
CRISPR/Cas9は細菌中で発見されたシステムで、特定のDNA配列を認識してその部分を切断することが可能なことから、それがゲノム編集に応用された。切断されたDNA領域は修復の過程でエラーが入り、その部位にある遺伝子が欠失することになる。特定の遺伝子を細胞内で欠失させることができる技術として、現在ではさまざまな研究に活用されている。しかしCRISPR/Cas9も万能というわけではなく、遺伝子によっては標的部位の設計が難しいことがあり、研究開発を進める上で妨げとなるとされている。
そこで研究チームは今回、これまでの研究でT細胞において遺伝子を改変するために設計した、200種類以上のCRISPR/Cas9の設計情報と、遺伝子を欠失させられたかどうかについてのデータを照合し、効率的な設計方法に関する条件を探すことにしたという。
その結果、狙う遺伝子領域のアクセスのしやすさに関するデータ(エピゲノム情報)を参照することで、どの領域を狙うのが効率的であるのかを精度良く予測できることがわかったとした。
細胞の性質は2万種類以上ある遺伝子の発現レベル(どれぐらいの量が存在するか)によって決定されるが、その遺伝子配列は細胞内の核に存在するDNAに組み込まれており、簡単に読み出せるわけではない。その発現開始には遺伝子周辺のDNA構造が開いている必要があり、このアクセスのしやすさを制御するDNAやその周辺のさまざまな修飾情報を総称してエピゲノムプロファイルと呼ばれている。また、欠失させたい遺伝子によっては全領域にわたってアクセスしにくい場合や、T細胞の状態によって遺伝子欠失が難しい場合もあるが、それらの状況でも効率的な編集を可能にする設計方法およびT細胞培養方法が開発されたという。
さらに、今回の研究で得られた手法をもとに、効率的に遺伝子を欠失させる部位を自動的に見つけるプログラムを開発し、すべての研究者が利用できるように一般公開も開始したとも研究チームでは説明しており、今後、今回のツールが、T細胞の機能を高めるための研究開発のさらなる加速に役立つことが期待されるとしている。