慶應義塾大学(慶大)は10月13日、単糖が鎖状に連結した分子である糖鎖の中でも、五員環糖の1つである「β-アラビノフラノシド」(β-Arbf)に着目し、「芳香族ボロン酸」を用いることで、完全な立体選択性および高い位置選択性で、効率的な配糖化が行える有機化学的新手法の開発に成功したことを発表した。
同成果は、慶大大学院 理工学研究科の稲葉和樹大学院生、同・内藤優奈、同・立花実奈大学院生、同・大学 理工学部応用化学科の戸嶋一敦教授、同・高橋大介准教授らの共同研究チームによるもの。詳細は、独国化学会の刊行する機関学術誌の国際版「Angewandte Chemie International Edition」に掲載された。
単糖類とは糖類の中で最も単純で、それ以上に分解できないものであり、そうした単糖類が鎖状に連結した糖鎖は、恒常的な生命現象や多種多様な疾病に関連していることが明らかにされつつあり、近年、糖鎖は核酸およびタンパク質に次ぐ「第三の生命鎖」ともいわれるようになっている。
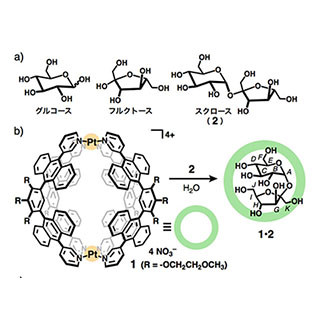
β-Arbfは、単糖類の一種で植物の細胞壁に存在する「アラビノフラノース」が連なった糖鎖であり、これまで結核菌の細胞壁、植物ホルモン、およびアレルギー抑制効果を示す糖タンパク質など、さまざまな生物活性分子に含まれる重要な構成要素であることがわかっている。しかし、天然から抽出されるβ-Arbfは、構造が不均一かつほかの分子との混合物として得られるため、それらの機能解明に関する研究が遅れており、β-Arbfを構造に含む純粋かつ構造が明確な糖鎖の化学合成とそれらを用いた構造活性相関研究の推進、さらには新たな医薬品のリード化合物の創出が求められていたという。
糖鎖の化学合成で特に問題となる立体選択性、つまり結合の向きには、α-結合(異なる向き)とβ-結合(同じ向き)の2通りがある。一般に、糖と糖をつなげる「グリコシル化反応」では、前者のα-Arbfの生成が優先され、β-Arbfはほとんど生成されない。多種多様な化学合成法が開発されている現代においても、立体選択性を完全に制御したβ-Arbf合成は課題として残されており、効率的な新手法の開発が望まれていたという。そこで研究チームは今回、開発してきたBMAD反応をアラビノフラノースに適用することで、従来にない立体特異的β-Arbf合成法の開発を試みることにしたとする。
今回開発された反応では、一部の酵素反応で見られる特異な「SNi型機構」(基本的にはSN2反応だが、反応中心の立体配置が反転しない反応)で進行する特長を有しており、同反応を利用することで、これまで非常に困難だったアラビノフラノースのβ立体選択性を制御することが可能になったという。
また同反応では、多くの従来法で用いられていた金属試薬や強酸性試薬を必要とせず、温和な条件下で反応を行える環境低負荷な糖鎖合成法であることも重要な点としている。
さらに今回の研究では、同反応の位置選択性の予測モデルの構築を、計算化学を用いて検討。その結果、同反応における位置選択性が、用いる基質に依存することが見出され、その選択性を事前に予測可能であることが判明した。たとえば、「ガラクトース3,4-ジオール」に対する反応では、C2位の立体化学がR配置の糖供与体を用いた場合、4位選択的に進行するのに対し、S配置の糖供与体を用いた場合には、3位選択的に反応が進行することが計算化学で予測され、実際に実験によって証明された。
加えてガラクトース3,4-ジオールに対するBMAD反応の条件の再精査を行ったところ、MeCN溶媒中、ボロン酸触媒を用いると、同反応の位置選択性が逆転することが見出され、配糖化位置の異なる2つの位置異性体を効率的に作り分けることに成功したという。
このほか今回の手法を、チモシーグラスの花粉より単離された抗アレルギー活性を示すアラビノガラクタン部分糖鎖合成に応用することで、同手法の有用性も確かめられたとしている。
なお、今回の研究では、芳香族ボロン酸を触媒として用いることで、金属試薬や強酸性試薬を必要とせずに、今まで合成することが困難だったβ-Arbfを完全な立体選択性かつ高い位置選択性で合成可能であることが明らかにされた。β-Arbfは、抗アレルギー活性を示す糖鎖に含まれることから、今回の手法を駆使した新規抗アレルギー剤の開発が期待されるとしている。