東京大学(東大)と国立国際医療研究センターの両者は7月31日、インフルエンザワクチン抗原デザインの新規ストラテジーとして、ウイルスタンパク質の保存性の高い部位を標的とする抗体を誘導する抗原デザインを新たに考案したことを共同で発表した。
同成果は、東大 国際高等研究所 新世代感染症センターの河岡義裕機構長らの研究チームによるもの。詳細は、微生物学に関連する全般を扱う学術誌「mBio」に掲載された。
現在市販されているインフルエンザワクチンの多くは、ウイルス表面にあるタンパク質「ヘマグルチニン」(HA)を標的とする中和抗体を誘導することが主眼とされている。中和抗体が特に効果的に働く標的部位は、HA頭部の受容体結合部位の周囲に集まっていることが課題だという。この部位ではアミノ酸変異が頻繁に起こり、中和抗体が効かないウイルスが出現しやすく、ワクチン株と実際の流行株ウイルスの不一致によりワクチンの効果が低減してしまうからである。
そこで研究チームは今回、HAのアミノ酸変異が起こりにくい部位を標的とする抗体を誘導することで、抗原性の異なるウイルスに対しても有効な免疫応答を誘導できるワクチン抗原の設計を目指すことにしたという。
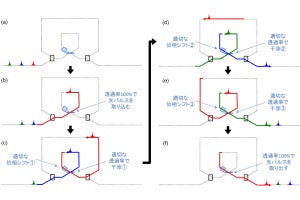
まず、A香港型(H3N2亜型)インフルエンザウイルスのHAが原型とされ、HA頭部の変異しやすい箇所すべてにランダムなアミノ酸置換を導入した変異体HAが樹立された。これらの変異体HAを混合することで、免疫原性の高い部位に多様なアミノ酸残基を持つ組換えHAワクチン抗原(スクランブルドHA(scrHA)が作製されたとする。
-
スクランブルドHA(scrHA)抗原作製のための変異体HAの樹立。(左)H3N2亜型インフルエンザHAにおいて、中和抗体が特に効果的に働く標的部位(主要抗原決定部位)が着色されており、拡大図にそのアミノ酸残基番号がある。いずれもHA頭部の受容体結合部位(Tyr98;赤色)の周囲に位置する。(右)主要抗原決定部位に位置する、野生型HAおよび18種類の変異体HAにおけるアミノ酸残基がアミノ酸一文字表記で示されている(.は野生型と同じアミノ酸残基を意味する)。(出所:東大 医科研プレスリリースPDF)
scrHAで免疫を賦与されたフェレットから血清が採取され、ワクチン抗原の野生型HAと抗原性が同一の(同抗原性)H3N2ウイルス、もしくは抗原性が異なる(異抗原性)H3N2ウイルスに対する中和抗体価が定量された。野生型HA免疫群では、同抗原性ウイルスに対して高い中和抗体価が誘導される一方で、異抗原性ウイルスに対しては高い抗体価は誘導されなかったとする。それに対してscrHA免疫群では、どちらのウイルスに対しても同様に一定程度の抗体価が誘導されたとした。
-
scrHA/野生型HAで免疫されたフェレットの血清における中和抗体価。フェレット(N=8/免疫群)がscrHAあるいは野生型HAで2回免疫され、2回目の免疫から3週間後に採取された血清における中和抗体価について、同抗原性H3N2ウイルスおよび異抗原性H3N2ウイルスに対する定量がなされた。図中、破線は同アッセイにおける検出限界の値が示されている。(出所:東大 医科研プレスリリースPDF)
次に、scrHAで免疫が賦与されたフェレットにウイルスを接種させ、感染後の症状やウイルス増殖の比較が行われた。同抗原性あるいは異抗原性H3N2ウイルスのいずれのウイルスを感染させても、scrHA免疫群と野生型HA免疫群では、鼻粘膜におけるウイルス増殖が同程度に抑制されたという。その一方で、感染に伴う発熱症状は、18種類の変異体HAを混合したscrHAで免疫した群のみ、いずれのウイルスの感染時にも有意に抑制されたとした。
scrHA免疫群では、同抗原性ウイルスに対して誘導される中和抗体価は野生型HA免疫群より低かったものの、鼻粘膜におけるウイルス増殖および発熱症状が抑制されたとし、生体内で中和抗体に依らない免疫応答も誘導されていることが示唆されるという。
-
scrHA/野生型HA免疫のH3N2ウイルス感染への防御効果。scrHAあるいは野生型HAで免疫したフェレットを、同抗原性H3N2ウイルス(上)あるいは異抗原性H3N2ウイルス(下)で感染させ、感染後7日間にわたり、鼻スワブ中のウイルス力価(左)と体温変化(右)が観察された。一群あたり4匹の平均値を示す。(出所:東大 医科研プレスリリースPDF)
そこで、ウイルスを感染させる前に採取された血清に含まれる抗体の性質をさらに詳しく調べるため、HA結合抗体をELISAで検出し比較を行ったとする。すると、scrHAで免疫した場合には、野生型HA免疫に比べ、頭部の変異しやすい部位よりも変異しにくい保存性の高い部位を標的とする抗体が多く誘導されることが明らかになったとする。
-
scrHA/野生型HAで免疫されたフェレットの血清におけるHA結合抗体価。scrHAあるいは野生型HAで免疫されたフェレットの感染前血清におけるHA結合抗体価を、異なるHAをELISA抗原として用いて検出が行われた。一群8匹の平均値を示す。(出所:東大 医科研プレスリリースPDF)
近年の先行研究で、インフルエンザHA頭部の変異しやすい部位を標的とする抗体はウイルスの中和に高い効果がある一方で、抗体のエフェクター機能とよばれる、抗体と免疫細胞が共働する免疫応答には抑制的に働くことが知られている。scrHA免疫は、保存性の高い部位に対する結合抗体を誘導することにより、中和活性のみに依らない免疫応答を誘導し、動物個体において感染防御に寄与することが示唆されたとした。
今回の研究で得られた知見は、インフルエンザワクチンにとどまらず、変異しやすいウイルスに対してより保存された部位を標的とする免疫応答を誘導するワクチン抗原の設計に有用な知見と考えられるとしている。