九州大学(九大)は4月5日、生体のエネルギーセンサとして重要な役割を担っている甘味受容体サブユニット「TAS1R3」の膜貫通ドメインの活性化・不活性化過程の構造予測に、シミュレーションを用いて成功したことを発表した。
同成果は、九大大学院 歯学研究院の實松敬介講師、同・重村憲徳教授らの研究チームによるもの。詳細は、英科学誌「Nature」系の生物学を扱うオープンアクセスジャーナル「Communications Biology」に掲載された。
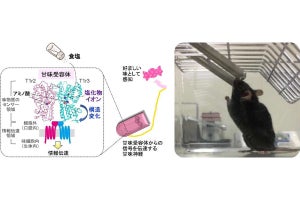
ヒトはエネルギー源である糖を摂取しやすいよう、糖を甘くおいしいと感じる。舌を中心に、口腔、咽頭、喉頭蓋領域の上皮層に分布する味覚器「味蕾」は、1つあたり100個ほどの味細胞が存在し、その中の甘味細胞に発現する甘味受容体が活性化することで、甘味の受容は始まる。甘味受容体のTAS1R2/TAS1R3は、「Gタンパク質共役型受容体」に属し、2種類のサブユニットが協調することで、構造の異なるさまざまな甘味物質に対し、その受容を担うことがわかっている。
-
甘味受容体は、2つのサブユニット「TAS1R2」と「TAS1R3」が二量体(複合体)を形成し受容体として機能する。甘味受容体TAS1R2/TAS1R3は、細胞膜に発現し、細胞外に長いN末端ドメイン、システインを含むCリッチドメイン、そして7回膜貫通ドメインから構成される。甘味物質や甘味抑制物質の結合サイトの同定は進んでいるが、どのように活性化・不活性化するのかは謎のままだった。今回TAS1R3の膜貫通ドメイン(点線)の構造変化が予測された(出所:九大プレスリリースPDF)
また近年になって、甘味受容体は、口腔以外にも全身のさまざまな臓器に発現していることがわかってきた。たとえば腸管では糖吸収に関与するなど、エネルギーセンサとして生体恒常性の維持に寄与していると考えられている。
これまで甘味物質や甘味抑制物質の甘味受容体に対する結合サイトの同定は、人工味細胞による受容体の機能解析とドッキングシミュレーションを基に行われてきた。同シミュレーションは、受容体と作用物質の結合サイトの予測は可能である一方、その結合が実際どのように受容体構造に影響して、シグナル伝達を引き起こすのか、動的な活性化・不活性化メカニズムは謎のままだったという。
そこで研究チームは今回、まず分子動力学シミュレーションを用いて、TAS1R3の膜貫通ドメインと人工甘味料(シクラメート)や甘味抑制物質(ギムネマ酸・ラクチゾール・サッカリン)との相互作用について調べたとする。
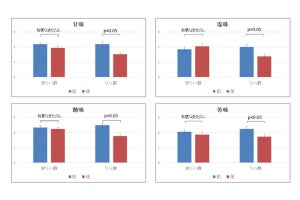
人工甘味料や甘味抑制物質は感受性に種差があり、ヒトの受容体に効いてマウスの受容体には無効だという。今回のシミュレーションでは、ヒトの受容体では結合し続けるギムネマ酸が、マウスの受容体では結合部位から外れる過程が認められ、ヒト-マウス間の感受性の種差がシミュレーション上で再現された。
そして、受容体構造の活性化モデルと不活性化モデルの比較から、ヒトの甘味受容体に対して甘味料として働くシクラメートが、マウス受容体では甘味抑制物質として作用することも見出されたという。
受容体の不活性化過程において、細胞膜外側に存在するTAS1R3の膜貫通領域結合サイトにおける甘味抑制物質との相互作用は、分子内相互作用により、結合サイトとは離れた細胞内側の膜貫通ヘリックスIII-VI間に形成される水素結合を安定化させることが予測された。一方で、受容体の活性化過程において、人工甘味料のシクラメートとの相互作用はこの水素結合を切断し、シグナル伝達が進むことが示唆されたとする。
人工味細胞を用いた機能解析では、水素結合を構成するアミノ酸残基に変異を与えると受容体機能が失われること、またその周囲のアミノ酸残基のヒトの一塩基多型(R757C)は甘味感受性を低下させることが明らかにされた。このことは、分子動力学シミュレーションの予測結果を強く支持したという。
また、人工甘味料のサッカリンは、酸性条件下で甘味の感受性が低下するが、TAS1R3膜貫通ドメインのサッカリン結合部位周囲のヒスチジン残基がpH感受性のマイクロスイッチとして機能し、サッカリンに対する感受性がpHにより調節されることが明らかにされたとしている。
研究チームは今回の研究成果から、糖尿病患者や肥満者に対し、QOLを上げる糖の甘味を増強するような甘味増強物質の開発につながる可能性が考えられるとする。また、全身のさまざまな臓器で発現する甘味受容体のエネルギーセンサとしての機能制御にも新たな手段を提示するものになり、血糖値をコントロールする物質の開発など、エネルギー代謝調節に関与する医薬品や機能性食品への応用・展開が期待されるとした。さらには、甘味受容体が属するほかのGタンパク質共役型受容体の動的活性化機構において、重要な知見を提供するとしている。