東京慈恵会医科大学(慈恵医大)、大日本住友製薬、日本医療研究開発機構(AMED)の3者は3月1日、ブタ腎臓の移植手術は胎仔の腎臓を用いる方が、より拒絶反応が弱くなることをサルを用いた実験により証明したと発表した。
同成果は、慈恵医大 腎臓・高血圧内科の横尾隆教授と大日本住友製薬の共同研究チームによるもの。詳細は、バイオエンジニアリングなども含む工学科学の全般を扱う学術誌「Engineering」に掲載された。
臓器移植は臓器不全の根本的な対策として知られているが、どの臓器も慢性的なドナー不足が課題となっている。この解決策として、以前からブタを利用した異種移植の研究が進められてきたが、多くの免疫抑制剤管理を行ったとしても長期の維持は難しく、利用可能な技術には至っていないという。また、ヒトiPS細胞から臓器を再生させる手法も、生体で機能を持った実質臓器レベルのものを完成させるまでには至っていない。
これまで胎仔の組織は、移植において拒絶反応が出にくいとされてきたが、実際にブタの胎仔腎臓をサルへ移植しても生着ができ、さらに出生後の腎臓よりも免疫原性が低いかは不明だったという。そこで今回の研究では、遺伝子改変を行っていない野生型ブタの胎仔腎臓と生後間もない新生仔腎臓を、臨床でも使用される免疫抑制剤のみを投与したサルに移植することを試みることにしたという。
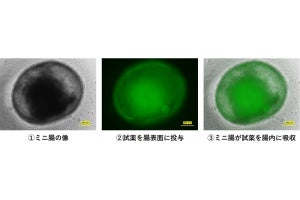
具体的には、2つの腎臓と尿管膀胱を含む複合腎臓(クロアカ:膀胱付き腎原基)が採取され、サルの腹部大動脈と尿管に近い後腹膜下にポケットを作り、血管吻合を行わずにそのまま静置での移植が実施された。一方、新生仔腎臓はサルの左側腎臓を摘出後、同所に血管や尿管ごと吻合し移植するという独自開発の手法で行われた。
その後、米国食品医薬品局(FDA)で臨床使用が承認されている免疫抑制剤を使用し、1匹のサルに2つの腎臓組織、ブタ胎仔クロアカグラフトの静置移植と、新生仔腎臓の血管吻合移植を実施。その結果、ブタの新生仔腎臓は約2週間後に拒絶反応による組織傷害が強く見られ、移植腎臓を摘出することでサルの死亡を食い止める必要が生じたとするが、同時に移植された胎仔腎臓は、同一のサル体内で2か月以上も大きな拒絶反応を起こすことなく、糸球体や尿細管などが発育することが確認されたという。
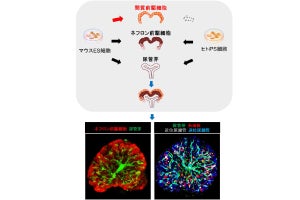
胎仔クロアカグラフトの免疫反応の弱さを再度検証するために、臨床使用される免疫抑制剤を長期間使用しながらその生着の経時的な観察も実施されたが、移植されたブタの胎仔腎臓は徐々に発育を続けることが確認されたとするほか、病理像ではレシピエントであるサルの血管が入り込んでいること、ならびにレシピエントの組織と一部キメラ化することも確認され、胎仔腎臓移植の免疫拒絶の低減が実証されたという。
研究チームはこれまでに、マウス-ラット間の小動物間の実験ではあるが、キメラが異種の免疫拒絶反応を低減できることを実験的に証明済みとするほか、柔らかいブタ胎仔腎臓原器を腹腔鏡で安全に移植できるデバイス開発や、移植し発育した膀胱とホストの尿管をつなぐハイブリッドステントの開発にも成功しており、ヒト臨床で行うための準備を進めているとしている。
また、独自の完全型再生医療と異種移植との利点を兼ね備えたキメラ臓器による「胎生臓器補完法」が、ブタ胎仔腎臓が患者の体内で育ちながら患者本人の腎前駆細胞がブタ胎仔腎臓の組織を置き換えることで免疫抑制剤を必要としなくなることを目指しているともしているが、その実現には、患者由来のiPS細胞から迅速に腎前駆細胞を作る技術や、薬剤によるブタ組織が消失する遺伝子改変ブタの作製などの課題が残されており、これらの課題解決に向けた共同研究を進めているとしている。