医薬基盤・健康・栄養研究所(NIBIOHN)は2月24日、食事で摂取したオメガ3脂肪酸の健康増進作用に関する新しいメカニズムとして、腸内細菌による代謝が重要な役割を担っていることを明らかにしたと発表した。
同成果は、NIBIOHN ワクチン・アジュバント研究センターの國澤純センター長、同・長竹貴広主任研究員を中心に、京都大学、愛知がんセンター、大阪大学、浜松医科大学、東北大学、東京大学、筑波大学、神戸大学、高崎健康福祉大学、慶應義塾大学、理化学研究所、横浜市立大学、周南市立新南陽市民病院、早稲田大学の研究者も参加した共同研究チームによるもの。詳細は、粘膜組織が関与する免疫と炎症の全般を扱う粘膜免疫学協会が刊行する公式学術誌「Mucosal Immunology」に掲載された。
α-リノレン酸やエイコサペンタエン酸(EPA)、ドコサヘキサエン酸(DHA)などのオメガ3脂肪酸は、ヒトなどのほ乳類では体内では合成できず、食事により摂取する必要のある必須脂肪酸として知られており、近年はサプリメントなどとして入手できるようになってきたが、その効果には個人差があることが指摘されている。
また、腸内細菌が健康に関与することが近年の研究から指摘されるようになっており、そのメカニズムの1つとして、食品成分を基質として腸内細菌が産生する「機能性代謝物(ポストバイオティクス)」の作用に注目が集まっている。食の効能を規定する因子として腸内細菌の代謝に着眼することで、高度な個別化/層別化栄養・医療の実現に繋がるという。
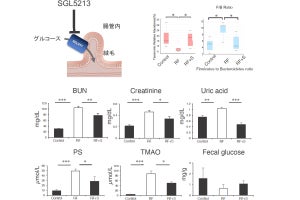
こうした背景のもと、今回の研究では、アマニ油やエゴマ油に含まれるオメガ3脂肪酸である「α-リノレン酸」が、腸内細菌にユニークな飽和化代謝を経て「αKetoA」に変換されることが見出された。
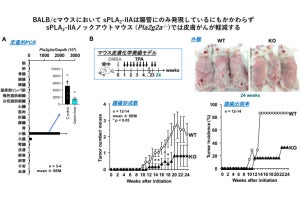
αKetoAの効能検証が行われたところ、抗炎症活性があることが判明したほか、免疫細胞の1つであるマクロファージに作用して、アレルギー性接触皮膚炎を抑えることや、糖尿病の病態を改善することが動物モデルで解明されたという。また、αKetoAの抗炎症作用の分子メカニズムとして、「ペルオキシソーム増殖因子活性化受容体」(PPARγ)に作用することも判明したという。
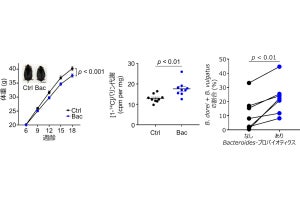
さらに、αKetoAはヒト糞便中からも検出され、α-リノレン酸を多く摂取することでαKetoAの産生量が増加することも確認されたものの、その産生量には個人差が認められ、腸内細菌叢が異なることが要因と考えられると研究チームでは説明している。
今回の研究では、動物モデルとヒト検体でαKetoAの存在が確認され、動物モデルにおいて炎症性疾患に対する有効性が見出されたが、ヒトでの有効性は今後の検討課題だと研究チームではしているほか、αKetoAの産生を担う腸内細菌の同定を含め、ポストバイオティクスの産生における腸内細菌と食事の関係を明らかにし、健康状態や病態と結びつけることで、個人ごとに最適な栄養指導や医療を提供する個別化/層別化栄養・医療の実現が期待されるともしている。