塩野義製薬は2月25日、新型コロナウイルス感染症(COVID-19)治療薬として開発中の経口抗ウイルス薬(3CLプロテアーゼ阻害薬、開発番号:S-217622)について、第2/3相臨床試験のうちPhase 2b partの主要評価項目に関する解析が完了したことを受け、日本国内における条件付き早期承認制度の適用を希望する製造販売承認申請を行ったことを発表した。
現在実施されている第2/3相臨床試験のうち、Phase 2b partは、軽症/中等症のSARS-CoV-2感染者428例(日本:419例、韓国:9例)が無作為化割付けされたプラセボ対照二重盲検比較試験。オミクロン株流行後の感染者を中心に評価がなされたもので、低用量の治療薬もしくは高用量の治療薬を1日1回、5日間経口投与した際の抗ウイルス効果および臨床症状の改善効果を確認することを主目的に実施されている。
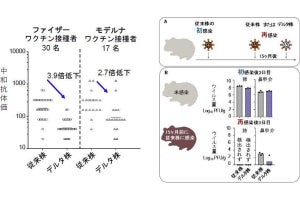
結果としては、治療薬を投与することで、両用量群ともにプラセボ群と比較して、4日目(3回投与後)において有意にウイルス力価を減少することを確認。4日目時点におけるウイルス力価陽性患者の割合は両用量群ともに10%未満で、プラセボ群との比較でPhase 2a partの成績を上回る減少率であったという。
また、COVID-19の12症状合計スコアの初回投与開始から120時間(6日目)までの単位時間あたりの変化量は、プラセボ群と比較して改善方向に推移したものの、統計学的に有意な差は認められなかったものの、12症状のうち、今回の試験で集積した集団で特徴的な症状であった呼吸器症状(鼻水または鼻づまり、喉の痛み、咳、息切れ(呼吸困難))の合計スコアにおいては、両用量群ともに有意な改善効果を確認したとしている。
なお同社では、同治療薬の一日でも早い提供を目指し、試験のさらなる追加解析データを速やかに医薬品医療機器総合機構(PMDA)へ提出するとしているほか、進行中の軽症/中等症のSARS-CoV-2感染者を対象としたPhase 3 part(目標症例数:1260例)、無症候/軽度症状のみ有するSARS-CoV-2感染者を対象としたPhase 2b/3 part(目標症例数:300~600例)における評価を加速し、結果が得られ次第、速やかに提出するとしている。