広島大学は2月5日、水素化リチウムを用いたケミカルルーピング(擬触媒)プロセスによるアンモニア合成方法を、常圧で高効率に制御する技術を開発したと発表した。
同成果は、広島大 自然科学研究支援開発センターの宮岡裕樹准教授、同・新里恵多助教、広島大大学院 先進理工系科学研究科の市川貴之教授、同・田川賢太朗大学院生、同・魏弘之大学院生らの研究チームによるもの。詳細は、ナノ・低次元・バルク材料の物理化学を扱う学術誌「Journal of Physical Chemistry Part C」に掲載された。
水素の社会活動のためには、貯蔵や運搬の際には、より扱いやすい別の物質(キャリア)とし、利用の際にそこから水素を取り出すといったことが考えられている。そうしたキャリアの候補の1つがアンモニア(NH3)だが、アンモニアの合成には100年以上前に考案された高温高圧条件を必要とするハーバー・ボッシュ法がいまだに主流であり、多くのエネルギーを消費する必要があり、より条件が緩い合成技術の確立が求められている。
NH3の合成において重要となるのが、安定な三重結合を有する窒素分子(N2)を原子状(N)に分離する窒素解離プロセスで、これまでこの窒素解離のために、1000℃近い高温条件やプラズマ、遷移元素や希土類元素などの金属触媒を利用する手法が用いられてきた。
そうした中、研究チームはリチウム(Li)の高い窒素解離能に注目。既存の触媒プロセスとは異なる多段階の化学反応によりNH3合成を行う、ケミカルルーピングプロセスの研究開発を進めてきたという。
水素化リチウム(LiH)を用いたケミカルルーピングNH3合成については、反応温度の低温化および効率化を目的とした貴金属触媒の利用が検討されてきたが、実用化を考慮した場合、貴金属触媒を利用するとコストが高くなるため、それを用いない方が望ましいとされる。
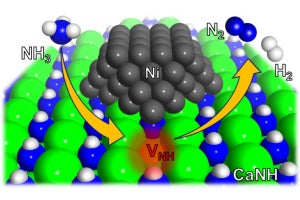
研究チームが進めてきたLiHを用いたケミカルルーピングによるNH3合成プロセスは、LiHの窒化反応(4LiH+N2→2Li2NH+H2)と、NH3合成およびLiHの再生反応(2Li2NH+4H2→2NH3+4LiH)で構成されており、一般的な触媒プロセス(N2+3H2→2NH3)とは異なる熱力学平衡でNH3合成を制御することが可能なため、高温においても高収率なNH3合成が可能になるという。そこで今回は、これらの反応を高効率に制御することを目的とし、反応温度、圧力条件を評価するとともに、反応プロセスに関する調査を行ったという。
その結果、窒化反応では、LiHは0.1MPa程度のN2ガスと反応し、約400℃から水素の放出を伴ってリチウムイミド(Li2NH)が生成されるが、その反応率は500℃まで加熱した時点で約60%、500℃で約1200分(20時間)保持しても約80%程度に留まることが確認されたことから、N2との反応後の試料に対する電子顕微鏡観察を行ったところ、生成物が融解凝集し粗大粒子を形成していることが示唆されたという。
そこで、このような反応過程での凝集の抑制を目的に、化学的に安定な物質である酸化リチウム(Li2O)を反応場としてLiHに混合してみたところ、LiH単相に比べ低温からN2と反応し、反応速度が低下することなく約20分でほぼ100%の反応率に達することが確認されたほか、反応後試料の電子顕微鏡像からも、生成物の明確な凝集は観察されなかったという。
一方のNH3合成/再生反応については、窒化反応で得られた生成物を、約0.1MPaのH2気流中で加熱して評価。その結果、LiHおよびLiH+Li2Oいずれの場合も約260℃からNH3の生成が観測され、LiHの再生も確認されたほか、窒化反応同様、反応場の効果が見られたとする。
今回のLiHを用いたケミカルルーピングによるNH3合成プロセスの2つの反応ともに発熱反応であり、反応のトリガーとしての熱エネルギーの投入以降は、原理的に反応熱を利用した自立制御が可能である点で優位性があると研究チームでは説明しており、今後は熱のマネージメントを含めた反応制御システムに関する研究に取り組む予定としている。また今回の研究では、反応場としてLi2Oが用いられたが、同様な安定物質であれば代替が可能であるため、実用化に向けて、より安価な物質の利用を検討したいともしている。