理化学研究所(理研)と大日本住友製薬は1月21日、特定の遺伝子を欠失させたヒトES細胞から網膜組織を分化誘導して移植に用いることにより、理想に近い生着を可能にする網膜組織を作製できることを明らかにしたと発表した。
同成果は、理研 生命機能科学研究センター 網膜再生医療研究開発プロジェクトの万代道子副プロジェクトリーダー(理研 創薬・医療技術基盤プログラム プロジェクトリーダー兼任)、同・山﨑優客員研究員(現・大日本住友製薬 再生・細胞医薬神戸センター 主任研究員)、大日本住友製薬 再生・細胞医薬神戸センターの桑原篤グループマネージャーらの共同研究チームによるもの。詳細は、生物学を扱う生命科学・物理化学・地球化学・健康科学を扱うオープンアクセスジャーナル「iScience」に掲載された。
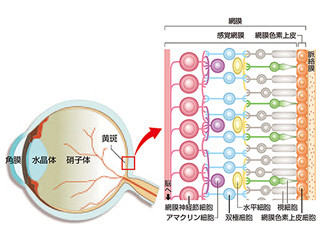
網膜は、光を感じて伝達する複数種の神経細胞(ニューロン)と、それを支える「網膜色素上皮細胞」で構成された複雑な組織で、眼に入ってきた光の刺激は、一次ニューロンである「視細胞(桿体視細胞と錐体視細胞)」が受容し、電気信号に変換された後、その電気信号が二次ニューロンの「双極細胞」に伝達され、三次ニューロンの「神経節細胞」を介して脳に届けられる仕組みとなっている。
-
眼球と網膜の基本構造。光が眼球の角膜、水晶体、硝子体を通って感覚網膜に達すると、視細胞で電気信号に変換される。電気信号は双極細胞を介して神経節細胞から脳に伝えられ、視覚情報として処理される (「RIKEN NEWS」2014年7月号より理研Webサイトに転載されたもの) (出所:理研Webサイト)
「網膜変性疾患」は、遺伝子の異常により、桿体視細胞が正常な機能を失い変性することで減少し始め、進行すると中心視野を担う錐体視細胞も徐々に減少し、視力低下や失明に至るという疾患であり、一度視細胞が失われてしまうと、既存の手法では治療不可能なため、多能性幹細胞から網膜の細胞や組織を分化誘導して移植する再生医療に期待が寄せられている。すでに、人においてiPS細胞から作製した網膜細胞の臨床移植手術も実施されている。
視機能の再生医療のための移植手法には、網膜組織を分散して視細胞のみ純化した液体(細胞懸濁液)を移植する方法と、理研などによって開発された網膜シート(網膜組織)を移植する方法の2種類がある。細胞懸濁液移植は、視細胞が移植先の双極細胞と直接接触するためシナプスが形成されやすいという利点が考えられるが、形態的な成熟や長期の生着は難しいとされている。
これに対して万代副プロジェクトリーダーらは、胎生期に相当する未熟な網膜シートを移植すると、視細胞が移植先で層構造を形成しながら成熟し、安定的に長期間にわたって生着することや、免疫原性が低いことなどの利点があることを報告してきた。
その一方で、移植網膜の中に残存する双極細胞が移植視細胞と宿主双極細胞とのシナプス形成を阻み、網膜シートの視機能再生効果を最大化できていない可能性も示されていたとする。
そのような背景のもと、万代副プロジェクトリーダーらの研究チームは、先行研究として、双極細胞の運命づけや成熟に関与する「Islet-1」などの遺伝子を欠失したマウスES細胞やマウスiPS細胞を用いた移植実験から、遺伝子を欠失させた移植後網膜は、成熟すると対照群(野生株)と比べて移植組織由来の双極細胞が減少し、宿主双極細胞と移植視細胞のシナプス形成が促進され、末期網膜変性モデルマウスの視機能がより効率よく改善できる可能性を見出していた。
今回の共同研究チームはそれをさらに発展させ、ヒトES細胞で双極細胞の形成に関わるIslet-1遺伝子を欠失させることにより、より機能性の高い網膜組織の作製が可能か否かを検証することにしたという。
-
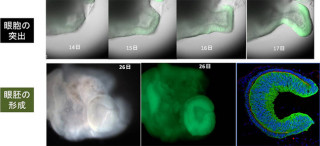
遺伝子改変ヒトES細胞から分化誘導した網膜組織のラットへの移植。Islet-1遺伝子を持つヒトES細胞(野生株)とIslet-1遺伝子を欠失させたヒトES細胞のそれぞれから網膜組織が分化誘導され、神経細胞マーカーの発現などが経時的に観察された (出所:大日本住友製薬プレスリリースPDF)
-
移植視細胞と宿主双極細胞のシナプス形成。(上)左の画像は、Islet-1遺伝子欠失ヒトES細胞由来の網膜組織を移植後の例。(下)Islet-1遺伝子欠失ヒトES細胞由来の網膜組織の移植例画像。移植視細胞と宿主双極細胞(白)のシナプス(画像中)を拡大すると、前シナプスマーカー(赤)と後シナプスマーカー(緑)の共局在が観察された(黄矢印)。白矢印は、黄矢印で指した箇所を二方向から観察した部分 (出所:大日本住友製薬プレスリリースPDF)
-
移植視細胞への光刺激に反応する宿主の神経節細胞。移植視細胞に対して強さの異なる光刺激(weak、medium、strong)を与えたときの宿主の神経節細胞の反応率が、多電極アレイシステムで解析された。反応率は、Islet-1遺伝子欠失ヒトES細胞由来の網膜組織移植(オレンジ)、Islet-1遺伝子を持つヒトES細胞(野生株)由来の網膜移植(青)、移植なし(灰)の順で高かった (出所:大日本住友製薬プレスリリースPDF)
-
宿主の神経節細胞の光刺激に対する反応率と相関する移植網膜の特徴。生着した移植網膜の状況は個体ごとに異なるため、どのような特徴が宿主の神経節細胞の光刺激に対する反応率の高さと相関するかが調べられた結果、移植視細胞と宿主双極細胞の接触率(左)や、網膜の内層構造の維持度(右)が光反応率と正に相関していることが判明。これらの特徴はいずれも、Islet-1遺伝子欠失ヒトES細胞由来の網膜組織移植(オレンジ)で顕著に見られた (出所:大日本住友製薬プレスリリースPDF)
その結果、胎生期相当の未熟な網膜組織を移植する従来の方法に加え、双極細胞の形成に関わる遺伝子を欠失させた多能性幹細胞を用いるという2つの工夫により、移植後の網膜細胞の分化を制御し、最終的により理想に近い網膜組織として生着させられることが確認されたとする。
-
今回の研究で実証された理想に近い網膜組織の再生。(左)Islet-1遺伝子を持つヒトES細胞(野生株)に由来する網膜組織移植では、移植片に多く含まれる双極細胞が移植視細胞と宿主双極細胞の接続を阻害するため、光刺激に反応できる神経節細胞の割合が少ない。(右)Islet-1遺伝子欠失ヒトES細胞に由来する網膜組織は、成熟しても双極細胞がわずかしか分化せず、移植視細胞と宿主双極細胞の接続が効率よく行われ、機能的な網膜組織となる (出所:大日本住友製薬プレスリリースPDF)
これまで、理研や神戸市立神戸アイセンター病院など、国内の研究チームは、網膜変性疾患に対する再生医療の臨床研究として、滲出型加齢黄斑変性に対する自家iPS細胞由来網膜色素上皮シートの移植(2014年)、他家iPS細胞由来網膜色素上皮細胞懸濁液の移植(2017年)、網膜色素上皮不全症に対する他家iPS細胞由来網膜色素上皮細胞懸濁液移植(2021年)を実施してきたほか、神戸市立神戸アイセンター病院は、網膜色素変性に対し、大日本住友製薬が製造した他家iPS細胞由来網膜シート(網膜組織)の移植(2020年)も実施してきた。これらはいずれも、正常な遺伝子型を持つヒトiPS細胞を用いて、治療法の安全性や有用性の検証のために実施されたものである。
今回の研究にて、移植に用いるヒト多能性幹細胞を遺伝子改変することで、より機能性の高い網膜組織を作製できることが示されたことから、今後、この技術をさらに発展させ、臨床応用可能な網膜組織移植法の確立を目指すとしている。