京都府立医科大学(KPUM)、大阪大学(阪大)、日本医療研究開発機構(AMED)の3者は6月21日、新型コロナウイルス(SARS-CoV-2)が感染する際のヒト細胞の受容体である「ACE2タンパク質」を改変してウイルスとの結合力を約100倍にまで高め、逃避変異にも対応した、抗体製剤と同等の治療効果を持つウイルス中和タンパク質の「改変ACE2受容体」を開発したと発表した。
-
今回の研究成果の概要図。(左)SARS-CoV-2とその変異株が、ヒト細胞の表面にあるACE2受容体タンパク質に結合する。(中央)現状の抗体製剤は、逃避変位したSARS-CoV-2に効果がない。(右)今回の改変ACE2なら、どれだけ逃避変位したSARS-CoV-2でもウイルス表面のSタンパク質に結合して、ヒト細胞への感染を防げる (出所:共同プレスリリースPDF)
同成果は、KPUM 大学院医学研究科 循環器内科学の星野温助教、阪大 蛋白質研究所の高木淳一教授、阪大 高等共創研究院の岡本徹教授(阪大 微生物病研究所兼任)らの共同研究チームによるもの。詳細は、英オンライン科学誌「Nature Communications」に掲載された。
これまで、新型コロナウイルス感染症(COVID-19)治療薬として、中和抗体製剤が開発され、使用されるようになってきた。ただし抗体製剤にはSARS-CoV-2が「逃避変異」を起こすことで、薬剤耐性を獲得する恐れがあるという課題がある。
実際に、これまでに開発された抗体製剤のいくつかについては、すでに効果が消失する変異株が存在しているため、複数の抗体を混ぜてカクテル製剤として用いる対応が取られている。そのため、COVID-19のような新興のウイルス感染症では、迅速に開発ができ、逃避変異が生じずに一度開発すれば感染症を克服するまで使用が可能な治療薬が求められている。
そうした背景を受けて研究チームは今回、迅速な開発が可能で逃避変異が生じない治療薬を開発するのにあたって、SARS-CoV-2のスパイク(S)タンパク質が侵入するためのヒト細胞側の“鍵穴”に例えられる受容体タンパク質「ACE2」に着目して研究を進めたという。
そして今回採用された、受容体の細胞外領域をヒト免疫グロブリン「IgG1」の重鎖定常領域とつなげた融合タンパク製剤は、すでに関節リウマチなどの治療薬として実用化されているものだという。
しかし、ACE2をターゲットとしたものの、実はSARS-CoV-2との結合力がそれほど強くなく、通常のタンパク製剤の血中濃度では有効な中和活性を示さなかったことが判明。そこで、ACE2のSARS-CoV-2との結合力を高めることに挑み、野生型(通常型)ACE2タンパク質よりウイルスとの結合力が亢進した高親和性ACE2(改変ACE2)を3種類取得することに成功したとする。
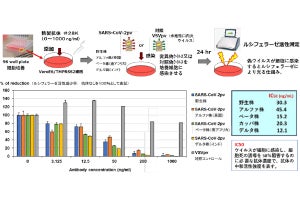
高親和性ACE2とSタンパク質の結合力に対し、表面プラズモン共鳴法を用いた測定が行われたところ、野生型ACE2の解離定数が17.63nMであるのに対して、3種類の高親和性ACE2は0.29~3.98nM(結合力が高いほど低い値になる)と、最大で100倍近い結合力の向上が認められたという。
また、ACE2をヒトの免疫グロブリンIgG1のFc領域と結合させた改変ACE2で疑似ウイルスに対する中和活性の評価も行われたところ、50%感染阻害濃度(IC50)が野生型では24.8μg/mlなのに対して、各種改変ACE2は0.056~0.33μg/mlと、最大で100分の1以下の濃度であることが確認されたとする。
さらに、ハムスターを用いてCOVID-19モデル動物実験を実施。体重変化と肺炎所見の評価が実施された結果、ウイルス感染により対照群では体重が4.3%低下したが、改変ACE2投与治療群では7.3%増加し、非ウイルス投与群(非感染対照群)と同等まで回復することが確認されたほか、肺組織のウイルス量も10分の1程度まで抑制され、感染すれば本来はCT画像で観察すると広範囲にすりガラス陰影が出現するのに対し、治療群では陰影が顕著に減少していること、ならびに肺病理組織では、治療群で肺胞出血や炎症細胞浸潤が少なく、肺炎の重症化も抑制されたことがわかったという。
-
COVID-19ハムスターモデルにおける改変ACE2の治療効果。(A)感染後のハムスターの体重変化。(B)肺組織のウイルスタイター(ウイルスの力価=感染価)とRNAゲノムコピー数。(C)CT画像。感染対照群で認めるすりガラス陰影は改変ACE2を投与した治療群で抑制されている。(D)肺病理所見。感染対照群では肺胞出血や炎症細胞浸潤が顕著だが、治療群では抑制されていることがわかる (出所:共同プレスリリースPDF)
SARS-CoV-2が逃避変異を起こすことで、改変ACE2に結合しなくなる可能性も存在するが、その場合は、より結合しにくい細胞表面の野生型ACE2とはさらに感染できないということになるため、実質的にヒトへの感染力を失うということになるため、実質的に逃避変異は生じないことが考えられると研究チームでは説明する。
また現在脅威となっているウイルス変異株に関しては、感染力が強いN501Y変異を持つ「アルファ株」に対しても有効であること、ならびにワクチンや一部のモノクローナル抗体が効きにくい免疫逃避型E484K変異を持つ「ベータ株」では、現在米国で使用が許可されているリジェネロン社の「REGN10933抗体」の中和活性が大きく低下することが分かってきたが、改変ACE2では中和活性が良好に維持されていたとした。
なお、今回の指向性進化法による改変ACE2の作出は1か月程度で可能で、また抗体製剤とは異なり患者検体を必要としないという利点もあるため、今回のCOVID-19だけでなく、将来の新たなウイルスパンデミックにおいても、薬剤耐性株出現の懸念なく迅速な治療薬開発が可能な新規モダリティとして期待されるとしている。
また、今後、日本でも拡大が懸念されているL452R変異を持つ「デルタ株」に対しても、改変ACE2が有効であることがすでに確認されているとのことで、現在、製薬会社と共同で前臨床試験を進めているという。