理化学研究所(理研)は、近年開発されたゲノム編集技術を改変した「塩基編集技術」を用いると、従来法に比べてマウスに遺伝子変異を高効率に導入でき、同時に複数の変異マウス系統を作製できることを発見したことを発表した。
この成果は、理研脳神経科学研究センター神経老化制御研究チームの西道隆臣チームリーダー、笹栗弘貴研究員、永田健一研究員らの共同研究チームによるもので、7月24日、英国のオンライン科学雑誌「Nature Communications」に掲載された。
近年、ゲノムDNAの配列解析技術は著しく発展し、疾患に関連する遺伝子変異の報告数が大幅に増加している。しかし、遺伝子の特定領域を置換する従来のノックイン技法でモデル動物を作製する場合、ひとつの点変異を持つモデルマウスですら数年かかることがあるため、それぞれの点変異が生体にどのような影響をおよぼし、疾患を引き起こすのかを明らかにするのは困難であった。
1990年代後半以降、ゲノムDNAを構成する塩基の配列を特異的に切断する酵素を用いて、ゲノムDNA上の目的の配列に変異を生じさせる「ゲノム編集技術」が次々と開発されている。しかし、2012年に報告されたゲノム編集技術の代表格である「CRISPR/Cas9」は、塩基配列の切断を伴うため、しばしば意図しない点変異が生じたり切断の痕跡がゲノムDNAに残ったりするという問題があった。この問題を解消するため、CRISPR/Cas9をもとに「塩基編集技術」という新しいゲノム編集技術が開発された。
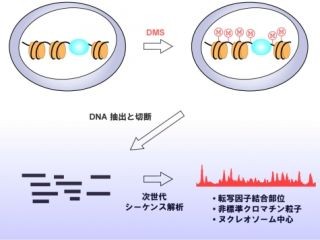
このたび共同研究チームは、「Base Editor(BE)」と「Target-AID」という2種類の塩基編集ツール(ともに2016年に開発)を用いて、プレセニリン遺伝子に点変異を持つマウス個体(変異プレセニリンマウス)の作製を試みた。
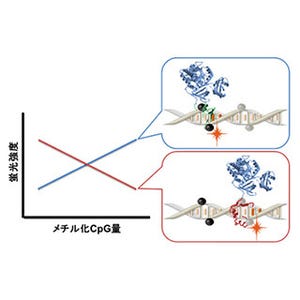
まず、プレセニリン遺伝子の1,306番目の塩基であるシトシンの、チミンへの置換を試みた。マウス受精卵にBEかTarget-AIDのいずれかとsgRNA (single guide RNA)を注入した後、個体の誕生を待ってゲノムDNAの配列を解析した。その結果、BEを使用した群では、シトシンからチミンへの点変異を含め、点変異を持つマウス個体は62.8%であった。一方、Target-AIDを使用した群では、点変異の導入効率はBEより低く、点変異を持つマウス個体は11.8%であった。しかし、BEを使用した群ではTarget-AIDを使用した群と比較して、チミン以外の塩基へ置換されている点変異や、ゲノムDNAの切断の痕跡が高頻度にみられた。つまり、BEは塩基の置換効率に優れるのに対して、Target-AIDは正確性に優れることがわかった。
次に、BEを用いて複数の変異マウス系統を同時に作製できるかを検証した。プレセニリンタンパク質の117番目のアミノ酸であるプロリン(P)がロイシン(L)やセリン(S)になると、家族性アルツハイマー病の発症原因となる。このようなP117L、P117Sの置換には、プレセニリン遺伝子の349番目と350番目の塩基にそれぞれ点変異を導入する必要があるものの、両者は隣接するため同時に標的とすることが可能である。そこで、300個のマウス受精卵にBEおよびsgRNAを注入し、個体の誕生を待ってゲノムDNAの配列を解析した結果、P117L、P117Sを含むさまざまな点変異を持つマウス個体は59.7%で、しかも45.5%は家族性アルツハイマー病の原因として報告されている点変異であった。
続いて、BEやTarget-AIDで作製した変異プレセニリンマウスが、アルツハイマー病の特徴を再現できるかを検証するために、アルツハイマー病発症の引き金と考えられている脳内のβアミロイド(Aβ)ペプチドの産生パターンを調べた。今回作製したP436S変異とP117L変異プレセニリンマウスを調べた結果、どちらもこの特徴を再現してAβ42が増えており、BEやTarget-AIDを用いたモデルマウスの作製方法が有効であることが示された。
さらに、今回の方法で作製したマウス個体のうち、これまで家族性アルツハイマー病の原因として報告されていなかった変異(P436L)を持つマウス個体でも、同様の異常なAβ産生パターンが認められることがわかった。このことから、同研究で用いた手法は、新しい病的変異を生体内でスクリーニングする方法としても有効であることが示された。
この成果により、塩基編集技術によるモデル動物への遺伝子変異導入が既存の手法に比べ著しく効率が高く、同時に複数の変異系統が作製できることがわかった。BEをはじめとする塩基編集技術は、現在最も注目されている科学技術のひとつであり、改良型も次々と開発・報告されている。塩基編集技術を使うことで、病的な点変異がどのようにして疾患を発症させるのか、個体レベルでの理解が今後急速に進んで行くと期待できる。
さらに、塩基編集技術は、従来のゲノム編集技術では遺伝子への変異導入が難しかった動物種でも有効である。共同研究チームは現在、さまざまな動物種への適応可能な塩基編集技術の特徴を利用し、新しい非ヒト霊長類のアルツハイマー病モデル作製に取り組んでいる。
この研究で作製した複数のモデルマウス系統は、アルツハイマー病の原因、病気のメカニズムの解明、治療方法の開発につながると期待できる。また、既存のAppノックインマウスなど他の遺伝子改変動物と交配することによって、さらに病理学的表現型の強いマウスモデルを作製できる可能性があるとしている。