理化学研究所(以下、理研)は、炎症や慢性閉塞性肺疾患(COPD)を抑える効果を持つ糖鎖「L4」の作用の仕組みを解明し、その作用を強めた新しい化合物を開発したと発表した。同研究成果により、感染症やCOPDに対する糖鎖を標的とした新しい治療薬の開発が期待できるという。
同研究は、理研グローバル研究クラスタ糖鎖構造生物学研究チームの山口芳樹チームリーダー(現、開拓研究本部伊藤細胞制御化学研究室研究員)、グローバル研究クラスタ疾患糖鎖研究チームの木塚康彦研究員(現、岐阜大学生命の鎖統合研究センター准教授)、太田芙美テクニカルスタッフ、谷口直之チームリーダー(現、大阪国際がんセンター研究所プロジェクトリーダー)、生化学工業中央研究所の平山哲也研究員、日本医科大学呼吸ケアクリニックの木田厚瑞所長、大阪大学微生物病研究所の山崎晶教授、マックスプランク研究所ColloidsandInterfacesのPeterSeeberger Directorらの国際共同研究グループによるもので、同研究成果は、4月7日付で欧州の科学雑誌「Biochimica et Biophysica Acta - General Subjects」オンライン版に掲載された。
慢性閉塞性肺疾患(COPD)は、気管支の炎症と肺気腫(肺胞の破壊)を伴う肺疾患で、COPDにかかると呼吸が苦しくなるとともに、ウイルスや細菌感染によって症状が急激に悪化(増悪)し、死亡率が上昇する。しかし、COPDには根本的な治療薬がなく対症療法が中心となっており、増悪時の強い炎症を抑えるためのステロイド薬の強い副作用も問題になっている。過去の研究では、L4と呼ばれる二糖がCOPDのモデルマウスで炎症を抑え、治療効果を持つことが明らかになっていたが、作用の仕組みは明らかになっていなかった。
まず、同研究グループは、L4に結合して抗炎症作用に関わるタンパク質を探索するため、免疫細胞上のC型レクチンに着目。その結果、樹状細胞という免疫細胞に存在する「ランジェリン」と呼ばれるC型レクチンが、L4と特異的に結合することが分かった。一方で、両者の結合の親和性は高くないことがわかったため、L4を複数個持つ分子(多量体)を作製して親和性を調べたところ、分子内にL4を3個持つトライアングルL4(Tri-L4)はL4単独の1,000倍以上、約30個持つペンダントL4は10万倍以上になっていた。
次に、ランジェリンを発現する樹状細胞とL4およびL4多量体との結合を調べた結果、L4ではほとんど結合が確認できない条件においても、ペンダントL4はランジェリン発現細胞と結合することが確認された。さらに、ランジェリンがリガンドと結合すると蛍光を発するレポーター細胞を用いた場合でも、L4ではほとんど蛍光が観察されないのに対し、ペンダントL4はほとんどの細胞で蛍光が観察され、ペンダントL4とランジェリンが生きた細胞膜上で結合することが分かった。
-
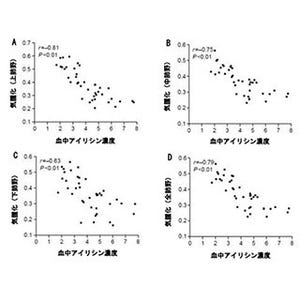
COPDモデルマウスでは、炎症が起きているため正常マウスより好中球やマクロファージなどの白血球が多い。しかしL4やTri-L4の投与により、これらの白血球の肺への集積が抑えられ、炎症が抑えられた。PBSはリン酸緩衝生理食塩水でコントロールの役割を果たす。(出所:理研ニュースリリース)
最後に、COPDモデルマウスにL4多量体を投与し、炎症抑制効果を調べたところ、Tri-L4は、L4と同等もしくはそれ以上の抗炎症効果があることが分かったという。なお、ペンダントは分子量が不均一で効果にばらつきがあったため、Tri-L4のみが試されたという。
同研究により、L4とランジェリンとの結合はL4を多量体化することで著しく強まること、またL4多量体はCOPDモデルマウスの肺で炎症を抑えることが分かった。このことから、L4多量体はCOPDをはじめとする炎症性疾患に有効な薬剤候補となる可能性が示されましたという。ランジェリンを発現する樹状細胞は、乾癬(かんせん)などの炎症性皮膚疾患との関連性も報告されており、L4およびその誘導体は、COPDだけでなく皮膚や粘膜の炎症、感染症などにも有効である可能性が考えられるということだ。