理化学研究所は、マウスを使った実験によって、アレキサンダー病(AxD)の病気の進行が、グリア細胞の一種、アストロサイトと呼ばれる脳細胞のCa2+シグナル興奮性が高くなることにより引き起こされることを明らかとしたと発表した。
-
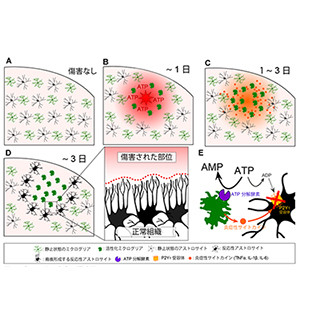
(A)AxCaシグナルを抑制した遺伝子改変マウスでは、アレキサンダー病の病態関連因子であるLCN2やGFAPの発現が抑制された (B)アレキサンダー病におけるAxCaシグナル病態の模式図
同研究は、山梨大学医学部薬理学講座の小泉修一教授、繁冨英治学部内講師、京都府立医科大学大学院医学研究科神経内科学の齋藤光象助教、吉田誠克准教授、水野敏樹教授らの研究グループと、慶應義塾大学医学部精神・神経科学教室の田中謙二准教授、生理学研究所の池中一裕教授、理化学研究所の御子柴克彦チームリーダーらとの共同研究によるもので、同研究成果は、2月1日に米国科学誌「GLIA」オンライン版に掲載された。
AxDは非常に稀な難治性神経変性疾患で、治療法が確立されていない難病である。これまでの研究で、AxDは、アストロサイト特異的な分子であるグリア線維性酸性タンパク(GFAP)と呼ばれるタンパク質の遺伝子に変異があると発症することが知られていた。GFAP遺伝子変異がGFAP凝集過程を惹起し、アストロサイトの細胞機能異常を引き起こすことは報告されてきたが、GFAPの遺伝子異常からどの様にしてこの病気が発症し、また進行していくのかについては不明のままで、また有効な治療法も見つかっていない。
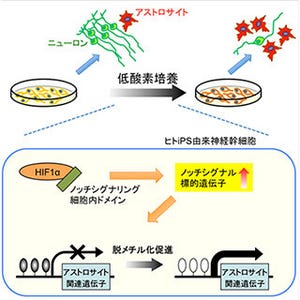
同研究では、アレキサンダー病の疾患モデルマウスとして、乳児期に発症する患者で比較的多いR239H変異を有するヒトGFAP遺伝子のトランスジェニックマウスを用いた。このマウスモデルのアストロサイトでは、巨大で高頻度に出現する異常Ca2+シグナル「AxCaシグナル」の発生が観察された。特に300μm2以上の面積に拡がる大きなCa2+シグナルは特徴的であり、これを「AxCaシグナル」と名付けた。さらに、このAxCaシグナル活動レベルは遺伝子型、週齢に依存して増大し、またGFAP発現レベルと相関することが分かった。
また、薬理学的実験の結果、AxCaシグナルは細胞内Ca2+貯蔵に依存することが明らかとなった。細胞内貯蔵からのCa2+放出を担う機能を持つタンパクであるイノシトール三リン酸受容体2型(IP3R2)をコードする遺伝子をノックアウトした動物モデル(IP3R2KOマウス)では、アストロサイトCa2+シグナルが大きく減少することが知られているが、このIP3R2KOマウスと今回のアレキサンダー病モデルマウスを交配させた遺伝子改変マウスでは、アストロサイトからのAxCa発生が抑制されていたという。さらには網羅的遺伝子発現解析から見出したLCN2やC3など病態関連マーカーおよびGFAPの発現レベルが抑制されていることも分かった。
同研究によって、アレキサンダー病の病態にアストロサイトの異常なCa2+シグナル活動「AxCa シグナル」が関与することを明らかにした。また、この異常なCa2+シグナル活動を抑制することによりGFAP遺伝子異常が存在しても病態が抑制される可能性が示唆された。今後は、AxCaシグナルが発生する機序、GFAPや他の病態関連因子の発現を誘導する詳細なメカニズムを解明し、そのコントロールを可能とする薬物を探索することによりヒトのアレキサンダー病に対する治療戦略を開発したいということだ。