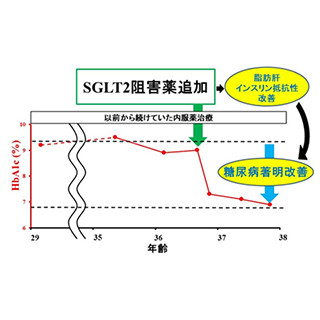
東海大学は、天然のインスリン(ウシ膵臓由来)に含まれるジスルフィド結合のひとつをジセレニド結合に置換した新規人工インスリン「セレノインスリン」の化学合成に成功したと発表した。
|
|
|
(a)天然のインスリンA鎖およびB鎖を用いたインスリン合成の概略 (b)セレン原子置換したインスリンA鎖およびB鎖を用いたセレノインスリンの合成の概略とセレノインスリンのX線結晶構造 |
インスリン分解酵素(IDE)による「セレノインスリン」(赤)と「インスリン」(黒)の分解反応速度の比較 |
同研究は、東海大学理学部化学科講師の荒井堅太および同学科教授の岩岡道夫、ならびに東北大学学際科学フロンティア研究所助教の奥村正樹、多元物質科学研究所助教の渡部聡および同研究所教授の稲葉謙次、大阪大学蛋白質研究所教授の北條裕信らの研究グループによるもので、4月10日付でドイツの国際化学誌「Angewandte Chemie International Edition」電子版に掲載された。
糖尿病患者にとって、インスリン製剤は命をつなぐ唯一の薬剤である一方、高頻度での皮下投与は肉体的・精神的な負担が大きい。創薬分野では、こうした患者の負担をできるだけ軽減しようと、長時間にわたって体内で循環・作用し、インスリンの基礎分泌を補助する新規持効型インスリン製剤の開発が大きな課題のひとつとなっている。投与後に血流によって体内を循環したインスリンは、最終的に腎臓内でインスリン分解酵素(Insulin Degrading Enzyme; IDE)によって分解され尿として排出されるが、同研究にあたっては、この IDEに対して高い分解耐性を示すインスリンを人工的に作成すること ができれば、長時間体内を循環する新しいタイプの持効型インスリン製剤の開発につながるものと考えたという。
インスリンは、二本の異なるポリペプチド鎖のA鎖およびB鎖が、硫黄(S)原子同士のジスルフィド(SS)結合によって安定化されており、A鎖とB鎖からインスリンを得ようとしても本来の目的のインスリンはほとんど得られない。そこで同研究チームは、反応性に富んだセレン(Se)原子に着目し、SをSeに置き換えたインスリンA鎖およびB鎖を用いれば、迅速にジセレニド(SeSe)結合が形成されるため、両ペプチド鎖の会合反応を効率的に行えるのではないかと仮説を立てたという。さらに、SeSe結合はSS結合よりも安定しており、インスリン分子に対して立体構造の“硬さ”と、それに起因するIDE分解耐性を同時に付与できるものと予想。まずはSe含有インスリンA鎖およびB鎖の化学合成に着手し、それらを得ることに成功した。さらに各ペプチド鎖を最適な条件下で混合し反応させることで、目的の「セレノインスリン」を最大27%の単離収率で得ることに成功した。
次に、X線結晶構造解析によって三次元立体構造を解析したところ、人工のセレノインスリンは天然インスリンと同様の立体構造を有していることが明らかとなった。そこで、セレノインスリンの細胞刺激応答を観測し、その生理活性を評価したところ、セレノインスリンは“インスリン”としての生理機能を保持していることが確認された。さらにIDEを用いて分解実験を行ったところ、セレノインスリンは天然インスリンよりも分解速度が著しく遅いことがわかった。これは、SeSe結合自身の安定性に加えて、IDEが認識しているインスリンの局所構造がセレノインスリンではごくわずかに変形していることに起因しているものと考えられるという。このような結果から、セレノインスリンは体内での薬効が長時間持続すると考えられ、新規持効型インスリン製剤としての応用が期待されるという。