京都大学(京大)などは3月31日、X線自由電子レーザー施設「SACLA」を用いた連続フェムト秒結晶構造解析(SFX)により、酵素の一種である「プロテイナーゼK」の構造を原子分解能で解析することに成功したと発表した。
同成果は、京都大学農学研究科 桝田哲哉助教、医学研究科 岩田想教授、理化学研究所 菅原道泰特別研究員、大阪大学蛋白質研究所 鈴木守准教授、高輝度光科学研究センター 登野健介チームリーダーらの研究グループによるもので、3月31日付けの英国科学誌「Scientific Reports」に掲載された。
プロテイナーゼKは、ケラチンを消化する機能を有する酵素で、分子生物学の領域では核酸精製の際によく用いられる。SFXにおいては、7keVや10keVのX線を用いた複数回以上の実験実績がある。
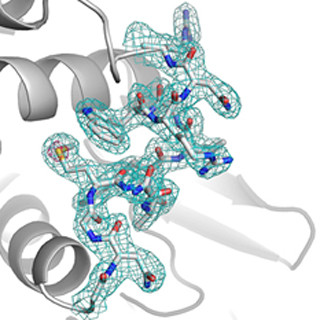
今回、同研究グループは、8~12μmのプロテイナーゼKの微結晶をセルロース媒体と混合し、13keVの高エネルギーX線を用いてSFX実験を行った。この結果、8万2000枚の回折イメージを収集し、1.20Åの分解能で構造決定を行うことに成功。またこれを解析することにより、常温で、αヘリックスやβストランドなどタンパク質の2次構造を形成する部位の水素原子の可視化にも成功した。
さらに同研究グループは、SPring-8で凍結低温条件下での単結晶構造解析も行い、今回のSFXで得られた構造と比較したところ、活性部位の構造は比較的似ていたが、近傍の水分子の配置が異なっていることを見出した。また常温特有のタンパク質側鎖の動きも確認した。非凍結結晶の解析結果との比較でも、これまで見出されていなかった部位での水分子の存在が明らかになっている。
同研究グループは、今回の成果で得られた技術や手法を用いて、常温特有のタンパク質や水分子の動き、酵素反応機構を明らかとすることで、医薬品や機能性素材の設計開発など、幅広い応用利用が期待されると説明している。