名古屋大学(名大)は3月21日、アルツハイマー病発症における主な原因のひとつであるアミロイドβタンパク(Aβ)の蓄積に密接に関わる糖鎖を発見したと発表した。
同成果は、名古屋大学大学院医学系研究科生物化学講座分子生物学 内村健治特任准教授、門松健治教授らの研究グループによるもので、3月20日付の米国科学誌「Proceedings of the National Academy of Sciences of the United States of America(米国科学アカデミー紀要)」に掲載された。
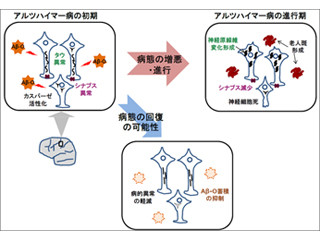
アルツハイマー病の脳では、Aβが何らかの原因により重合し沈着した結果、脳内にアミロイド斑が形成され蓄積し、神経細胞死や神経伝達に重要なシナプスと呼ばれる構造の脱落が起こる。アミロイド斑は通常、ミクログリアと呼ばれる脳内の免疫担当細胞により貪食除去を受けるが゙、この除去能力の低下によりアルツハイマー病の進行が促進される。
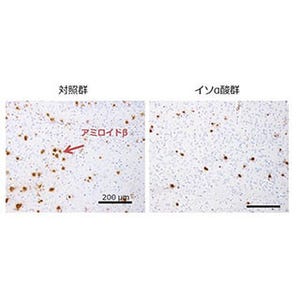
今回、同研究グループは、アルツハイマー病の進行に伴いミクログリアで発現誘導されるケラタン硫酸と呼ばれる糖鎖に着目し、アルツハイマー病モデルマウスの脳において、特にミクログリアの細胞表面に、病態進行に伴い同糖鎖が発現誘導されることを発見。また同時に、この糖鎖がシアル酸で修飾を受けた特殊な構造をもつ「シアル酸修飾ケラタン硫酸」であり、GlcNAc6ST1酵素により合成されることを明らかにした。
なお、GlcNAc6ST1酵素を欠失することにより、シアル酸修飾ケラタン硫酸糖鎖が消失し、ミクログリアによるAβの細胞性貪食が亢進され、アミロイド斑の沈着が抑制されることが確認されている。さらにモデルマウスだけではなく、アルツハイマー病患者脳においても同糖鎖と GlcNAc6ST1酵素の発現が亢進していることが認められたという。
同研究グループは、GlcNAc6ST1酵素に対する阻害剤や、糖鎖中和抗体を用いたアルツハイマー病新規治療法の開発が期待されると説明している。