横浜市立大学(横浜市大)は1月31日、エイズ(AIDS:後天性免疫不全症候群)の原因となるヒト免疫不全ウイルス(HIV)が体内で効率よく感染を拡げるための分子メカニズムを解明し、これに関わる宿主タンパク質を発見したと発表した。
同成果は、同大 学術院医学群 微生物学の梁明秀 教授、宮川敬 助教らと、国立感染症研究所、シンガポール国立大学、北里大学、米国ミシガン大学で構成される研究グループによるもの。詳細は英国の科学雑誌「Nature Communications」に掲載された。
HIVは全世界で3500万人が感染していると推測され、日本でも年間1500人が新規HIV感染者となっており、年々増加傾向にある。HIV感染を未然に防ぐワクチンはまだないものの、近年では、抗ウイルス薬の服用で、ウイルスの増殖を抑え、エイズの発症を遅らせることが可能となった。しかし、感染したウイルスを完全に体内から排除する治療法はまだ確立されておらず、また、長期間の抗ウイルス薬の服用によって耐性ウイルスの存在も報告されるようになってきており、そうした耐性ウイルスにも効果のある新薬の開発なども求められるようになっている。
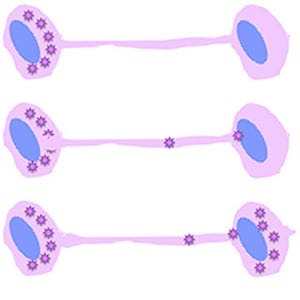
HIVの感染様式は、細胞外に分離・放出されたウイルス粒子によるcell-free感染と、隣接し合う感染細胞から非感染細胞に直接ウイルスを受け渡すcell-to-cell感染があり、cell-to-cell感染の方がcell-free感染に比べ、数十倍~数千倍ほど高い効率でウイルスを伝播することが可能とされている。その仕組みは、細胞と細胞の接合部に存在する構造体で、ウイルスの受け渡し場所としての役割がある「Virological Synapse(VS)」を介して行われ、ウイルスの基本構成要素である構造タンパク質GagやウイルスゲノムvRNAなどがVSまで輸送されることが重要とされてきた。しかし、そうしたメカニズムの詳細や宿主タンパク質の役割については、これまで良く分かっていなかったという。
研究グループは今回、GagとvRNAの細胞膜への輸送に着目。解析の結果、Gagに結合する宿主因子として、がん抑制遺伝子産物であるAPC(adenomatous polyposis coli)を同定したという。また、APCがGag、vRNAの輸送や制御にどのように関与しているかを検討した結果、ウイルス感染細胞にAPCを過剰発現させると、HIV産生量が約6倍に上昇すること、APCはGagおよびvRNAとともにVSに集積すること、APCを発現抑制した細胞では、VSへのGagとvRNAの集積が減少し、それに伴ってHIVのcell-to-cell感染伝播効率の低下が認められることなどを確認したという。
研究グループでは、この結果を受けて、APCがウイルス構成因子を細胞の特定の場所に集積させることでHIVのcell-to-cell感染を制御する宿主因子であると考えられるとするが、APCはがん抑制因子のため、それを完全に抑えることは生体機能において望ましくないともしており、APCの本来の機能を阻害せずにGagとの相互作用を阻止することができれば、HIVのcell-to-cell感染を阻止できる可能性があると説明。今後、APCのGag結合領域を模倣したペプチドや化合物、APCとGagの相互作用を抑制する化合物などを探索することで、ウイルス-宿主間相互作用を抑制する新しいタイプの治療薬開発へ展開させたいとしている。