京都大学(京大)は12月7日、マウス多能性幹細胞(ES細胞)から、試験管内にて精子幹細胞様細胞およびその長期培養株Germline stem cell-like cells(GSCLCs)を誘導することに成功したと発表した。GSCLCsは生殖細胞を欠損する成体マウスの精巣中で精子に分化し、健常な子孫を生み出すことができたという。
同成果は、京都大学大学院医学研究科 斎藤通紀教授、石藏友紀子特定研究員らの研究グループによるもので、12月6日付けの米国科学誌「Cell Reports」オンライン版に掲載された。
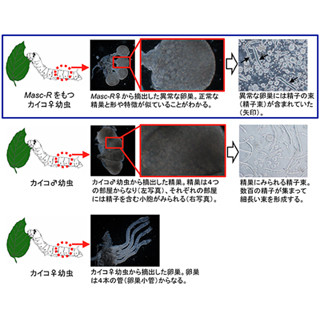
同研究グループは、これまで多能性幹細胞から始原生殖細胞様細胞を試験管内で誘導する手法を確立してきた。オスにおいて始原生殖細胞は、胎齢12.5日齢までに将来精巣のもととなる生殖巣体細胞に囲まれ、前精原細胞と呼ばれるようになり、その後、出生5日齢頃に、精原細胞および精子幹細胞へと分化する。
今回の研究では、始原生殖細胞が前精原細胞となる時点の細胞環境に注目。マウスES細胞から誘導した始原生殖細胞様細胞を、胎齢12.5日齢のマウス胎仔の生殖巣体細胞とともに凝集させて「再構成精巣」を作製し、精子幹細胞への分化が誘導される培養条件を検討した。
これにより、始原生殖細胞様細胞が精子幹細胞と同等の特性を示す細胞に分化する培養方法と培養期間を決定。さらにこの細胞を培養したところ、4カ月以上の長期間培養が可能であることが確認された。
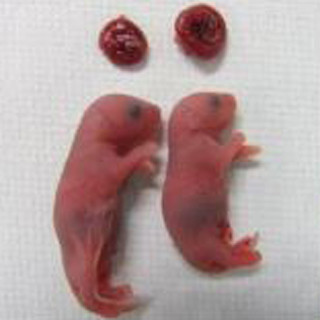
同研究グループは、この細胞株を「Germline stem cell-like cells(GSCLCs)」と命名。GSCLCsを生後7日齢の生殖細胞欠損マウスの新生仔および生後8週齢の成体の精巣に移植した結果、一部が精子まで分化し、得られた精子と卵子を顕微授精させると健常な産仔が得られることを確認している。
一方で、樹立したGSCLCsがマウスの精巣中で精子まで分化する効率は、生体由来のGS細胞より低効率となる20%程度であることがわかった。これは、試験管内で精子幹細胞へと分化させる過程で付与された過剰なメチル化が、精子分化に必要な遺伝子の発現を妨げるためであることが考えられるという。
同研究グループは、今回の成果について、今後、精子幹細胞の形成メカニズムの解明や、DNAのメチル化異常に起因する疾患の発症メカニズムの解明、ヒト始原生殖細胞様細胞からヒト精子幹細胞様細胞を誘導する方法論の開発などに貢献するものと説明している。