東京医科歯科大学(TMDU)は11月21日、オートファジーが中心体を構成するタンパク質Cep63を分解することによって、中心体数を制御していることを明らかにしたと発表した。
同成果は、東京医科歯科大学難治疾患研究所の大学院生 渡辺雄一郎氏、本田真也助教、清水重臣教授らの研究グループによるもので、11月21日付けの英国科学誌「Nature Communications」オンライン版に掲載された。
細胞が自己の成分を分解する「オートファジー(自食作用)」は、その機能が低下することにより発がんの原因となることが知られている。これまで、異常ミトコンドリアの除去異常や、細胞死の亢進、タンパク質p62の蓄積といった説が、オートファジー機能低下による発がんのメカニズムとして提唱されてきたが、同研究グループは今回新たに、オートファジーの機能低下によって中心体数の制御異常が起こり、染色体が不均等分裂することでがんが引き起こされるというメカニズムを新たに見出した。
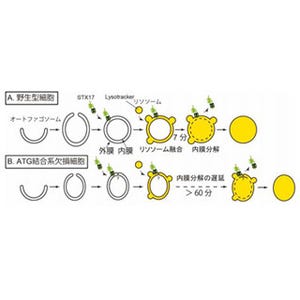
中心体は均等な染色体分配に必須な細胞小器官であり、その異常はがんの発生の原因となる。これまでの研究から、中心体の数はユビキチン-プロテアソーム系により制御されているものと考えられてきたが、今回の研究で、オートファジー関連遺伝子であるAtg5の欠損細胞において、中心体数が増加していることが明らかになった。同現象は、オートファジー阻害剤を投与したときにも観察されたため、オートファジー欠損により中心体数の増加が引き起こされるものと考えられる。
|
|
|
中心体数の異常により染色体が不均等分裂することでがんが引き起こされる |
Atg5欠損細胞や、Ulk1/Beclin1の発現が低下しオートファジーの機能破綻を起こした細胞では、中心体数が増加している細胞が多くみられた |
さらに同研究グループは、この原因として、通常オートファジーによって分解されている中心体タンパク質Cep63が分解されずに残存することが理由であることを明らかにした。したがって、オートファジーは、Cep63を分解することによって、中心体数を制御しているといえる。なおCep63は、オートファジーの選択的な基質認識分子のひとつであるp62によってオートファジーに取り込まれるため、p62欠損細胞においても中心体数が増加することがわかっている。
同研究グループは今後、ヒトのがん細胞やマウスを用いた実験を行い、オートファジーの異常によるがん発症機構の解明に向けてさらなる研究を進めていく考えだ。