国立がん研究センター(国がん)は11月11日、ラットおよびマウスの成熟肝細胞から肝臓を再構築する肝前駆細胞へのリプログラミングおよび安定培養に成功したと発表した。
同成果は、国立がん研究センター研究所分子細胞治療研究分野 落谷孝広分野長、勝田毅研究員らの研究グループによるもので、11月10日付けの米国科学誌「Cell Stem Cell」オンライン版に掲載された。
近年、多能性幹細胞を利用して再生能を有する移植可能な肝前駆細胞や成熟肝細胞を生体外で安定かつ安全に供給する試みが行われている。しかし、実際の移植実験において、これらの細胞によって置換される肝細胞の割合は15%以下であり、十分な肝再生の実現には至っていなかった。また多能性幹細胞の場合、移植後のがん化などの懸念もあり、実現化には多くの課題を抱えている。
同研究グループは今回、これまでに報告してきた幹細胞の安定培養に重要な4つの低分子化合物に着目。これらのすべての組み合わせを添加してラットの肝臓細胞を培養し、細胞が増殖するかどうかを検討した。
この結果、3つの化合物の組み合わせ(Y-27632、A-83-01、CHIR99021:YAC)を加えたときに、肝前駆細胞だけでなく、成熟肝細胞までもが増殖能を獲得し、形態的に幹前駆様の細胞へと変化することが明らかになった。つまり、YAC添加により、成熟肝細胞が、肝臓を再構築する肝前駆細胞へとリプログラミングされることがわかったといえる。これについて勝田研究員は「もともとは小型肝細胞の安定培養を目的とした実験であり、リプログラミングが起こるとは予想していなかった」とコメントしており、驚くべき結果であったことが伺える。
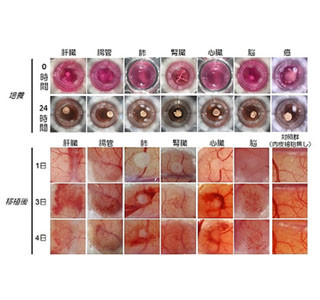
これらの肝前駆様細胞を、同研究グループは「CLiP(Chemically-induced Liver Progenitors)」と命名。CLiPに肝分化誘導または胆管分化誘導の刺激を加えると、実際に肝細胞または胆管上皮細胞へと分化することを確認している。
CLiPは、低分子化合物存在下で増殖能を失うことなく安定に培養することが可能で、長期培養後も肝分化誘導刺激を加えれば容易に肝細胞へと再分化させることができる。その一方で、低分子化合物を除去すると即座に増殖能を失うことから、CLiPががん細胞特有の自律的な増殖能を獲得した細胞ではないことがわかっている。なお、ラットだけでなくマウスの肝細胞を用いてもCLiPを誘導できることが確認されている。
また、長期培養に成功したラット由来のCLiPを、慢性肝炎モデルの免疫不全マウスの肝臓に移植し再生能力を評価した結果、すべてのマウス肝臓の75~90%が、ラット細胞に置換されていることがわかった。実際に、マウス血中のラットアルブミン濃度も移植後増加しており、CLiP由来の肝細胞が肝機能を示すことが確かめられている。また、置換率が75~90%に達した移植後8週間で摘出したマウス肝臓は、がん化することなく、大きさも正常で病理学的にも正常な構造であり、安全性の面でも問題ないという。
同研究グループは、今回の研究のアプローチをベースに、凍結保存されているヒト肝細胞や生検サンプルから採取したヒト肝細胞を利用して、移植治療に使えるヒトCLiPの誘導を目指し研究を続けていくとしている。ヒトへの応用には、ヒトCLiP作製のための技術確立のほか、大量培養系の確立や安全性の検証、組織適合性の検討などといったプロセスを踏む必要があるが、落谷分野長は、「今回の結果によってこういった道がようやく開けた」とコメントしている。