東京大学(東大)は、アルツハイマー病の発症予防因子「CALMタンパク質」が、老人斑の産生に関与する酵素の細胞内の局在を制御していることを明らかにしたほか、同酵素の活性はpHによる影響を大きく受け、特に酸性の環境では老人斑を構成するタンパク質(アミロイドベータ42:Aβ42)を多く産生することを見出したと発表した。
同成果は、同大大学院薬学系研究科の富田泰輔 准教授、同 諸橋雄一 元助教、同大大学院薬学系研究科の金津邦彦 大学院生、同 黒田浩正 大学院生、同大 大学院医学系研究科の岩坪威 教授、奈良女子大学大学院人間文化研究科の渡邊利雄 教授、同 鈴木麻衣 大学院生らによるもの。詳細は英国科学雑誌「Nature Communications」に掲載された。
アルツハイマー病は認知症の大部分を占める神経変性疾患の1つで、これまでの研究から、アルツハイマー病患者の脳には、老人斑と呼ばれるタンパク質の沈着が認められ、この主成分は40個程度のアミノ酸から成るAβペプチドであることが知られており、中でもアルツハイマー病患者脳では42アミノ酸からなる、凝集性の高いAβ42が優位に老人斑として蓄積していることが知られている。
また、近年のゲノム解析の視点からの研究により、アルツハイマー病の発症しやすさを決める遺伝学的リスク因子や発症予防因子の存在の1つとしてPICALM遺伝子近傍には、通常ではグアニン(G)である塩基が約36%の人でアデニン(A)となっている一塩基置換(Single Nucleotide Polymorphisms:SNPs)が存在し、アデニンを持つ人ではグアニンを持つ人と比べてアルツハイマー病のなりやすさが13%低いことが示されていた。しかしPICALM遺伝子がコードするCALMタンパク質がアルツハイマー病発症において果たしているメカニズムについては良く分かっていなかった。
そこで研究グループは今回、CALMの機能が半分に低下している遺伝子改変マウスの脳を生化学的に調査。その結果、Aβ42の量が減少していることを見出したほか、二本鎖のRNAを人工的に培養細胞に導入して、CALMの発現量を低下させて解析したところ、Aβ産生に関与している酵素の1つであり、Aβ42の産生量を決定しているγセクレターゼの切断機能を変化させていることが示されたという。これらの結果から、CALMはAβ42の産生量を制御することで、アルツハイマー病の発症リスクに影響を与えていることが示唆された。
この結果を受けて研究グループではさらに、CALMの機能解明を目的として、これまでに細胞内でどのように運ばれて、どこに存在するかは不明であったγセクレターゼの細胞内の局在を検討したところ、γセクレターゼが特に細胞表面からエンドサイトーシスによって細胞内に取り込まれ、エンドソームからライソソームへ輸送されていることを発見したという。
|
|
|
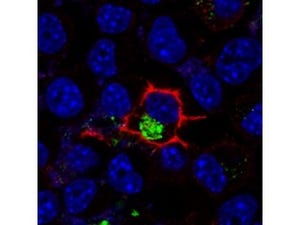
CALMは細胞表面から細胞内にγセクレターゼを取り込むために必要な分子であり、γセクレターゼの細胞内の局在を制御する。γセクレターゼが取り込まれた小胞内のpH変化に伴ってγセクレターゼによるAβ42の産生量が決まる |
また、それと合わせて、CALMの機能抑制によってγセクレターゼの輸送速度が著しく低下していることも判明したほか、CALMがγセクレターゼに直接結合していることも見出し、CALMはγセクレターゼのエンドサイトーシス輸送におけるアダプター分子であることが示唆される結果を得たとする。
そこでさらにγセクレターゼの輸送低下によるAβ42産生抑制のメカニズムの調査を目指し、エンドソームからライソソームへと輸送されていく過程において徐々に酸性化されていくところに注目し、エンドサイトーシスされた小胞におけるpHの変化を調べたところ、γセクレターゼの活性がpHによって大きく影響を受け、特に酸性の環境ではAβ42が多く産生されることを見出したという。これは、CALMによって細胞表面から取り込まれたγセクレターゼは、小胞内部が酸性化されていく過程でAβ42を多く作り出す活性を示す可能性が高く、CALMの機能が抑制されると、γセクレターゼの輸送が遅くなり、アルツハイマー病の発症リスクの低下につながることが示唆された結果であるという。
なお研究グループでは今後、CALMの機能のみを変化させる方法を明らかにすることで、アルツハイマー病治療薬のみならず、予防薬の開発につながることが期待されると説明している。