慶應義塾大学(慶応大)は2月26日、日本大学(日大)との共同研究により、「アクチン細胞骨格」の動態変化が脂肪細胞への分化を誘導するという現象の分子機構について解明したと発表した。
成果は、慶応大医学部 先端医科学研究所 遺伝子制御研究部門の信末博行 特任助教、同・佐谷秀行教授、日大 生物資源科学部 応用生物科学科の加野浩一郎教授らの共同研究チームによるもの。研究の詳細な内容は、現地時間2月26日付けで英オンライン科学誌「Nature Communications」に掲載された。
ヒトなどの多細胞生物の体は、形や働きが異なるさまざまな細胞によって形成されているが、このように細胞が特定の形と働きを持つようになることが、いわゆる「分化」である。細胞分化は種々の転写因子の発現によって誘導される仕組みで、未分化な前駆細胞から成熟した脂肪細胞へと分化する時には、受容体型核内転写因子「ペルオキシソーム増殖因子活性化受容体γ(PPARγ)」と呼ばれる転写因子がまず発現する仕組みだ。なおPPARγは、脂肪細胞の分化および発達に関わる遺伝子群の発現を直接制御することから、脂肪分化のマスターレギュレーターとして知られる。
他方、細胞は分化に伴って「アクチン(アクチン細胞骨格)」と呼ばれる細胞の骨組みを再構成し、それぞれの機能に特徴的な形態へと変化することが報告されてきた。しかし、アクチン細胞骨格の組み換えによる形態変化と分化という現象がどのような分子機構でつながっているのかは、まだ詳細はほとんどわかっていない。そこで研究チームは今回、アクチン細胞骨格の動態変化が引き金になって脂肪分化が誘導されることを見出し、その分子メカニズムの解明に向けて研究に取り組んだのである。
アクチン細胞骨格の動態について補足すると、細胞形態は主にアクチン細胞骨格によって決定され、アクチンは1個の「G-アクチン」とそれが重合した線維状構造を持つ「F-アクチン」の2つの形状を採り、アクチン動態はG-アクチンとF-アクチンの間での状態転移によって調節される仕組みだ。
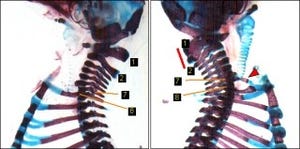
まず、脂肪細胞のみならず、骨、軟骨、心筋などの細胞に分化する多能性を有する「脱分化脂肪細胞株(DFAT)」を用いて、脂肪分化過程におけるアクチン細胞骨格の変化およびPPARγの発現に関する、時間を追った調査が行われた(画像1)。なおDFATは、マウスの脂肪組織から単離した成熟脂肪細胞を天井培養という方法で体外培養することにより、脱分化が誘導され、生じてくる線維芽様の細胞である。
その結果、DFATでは分化誘導24時間以内に「アクチンファイバー」に脱重合(バラバラになること)が生じ、48時間後に脂肪分化のスイッチであるPPARγが発現した後、脂肪細胞特有の表層アクチンが形成されることが判明。また、脂肪分化誘導したDFATにおいてアクチンファイバーの脱重合を阻害したところ、PPARγの発現および脂肪分化が有意に抑制されることも確認された。
さらに、アクチンファイバーの形成を誘導する低分子量Gタンパクの1種の「RhoAタンパク」の活性型変異体をDFATに強制発現させて分化誘導すると、アクチンファイバーの形成が促進され、PPARγの発現が抑制されることが判明。ただし、RhoAタンパクの下流で活性化される「Rhoキナーゼ(ROCK)」の阻害剤あるいはアクチン重合阻害剤で処理すると、アクチンファイバーは脱重合し、その結果PPARγの発現は回復することが見出されたのである(画像2・3)。従って、RhoA/ROCKシグナルの不活性化がアクチンファイバーの脱重合を促し、PPARγの発現および脂肪分化を直接制御することが明らかとなった。
|
|
|
|
画像2(左)・画像3(右):RhoA/ROCKシグナルがPPARγの発現に及ぼす影響。活性型RhoAを強制発現させると、PPARγの発現は抑制されるが(画像3・白色矢印)、これにROCK阻害剤あるいはアクチン重合阻害剤を加えることによってPPARγの発現は回復する(画像3・黄色矢印) |
|
次に、アクチンファイバーの脱重合がどのようなメカニズムでPPARγの発現を直接制御するのかを解明するために、脱重合によって生じた単量体G-アクチンと直接結合することで知られる転写活性化補助因子「MKL1(Megakaryoblastic Leukemia1)」に着目。脂肪分化過程におけるG-アクチンとMKL1の細胞内における局在変化についての調査が行われた。
なおMKL1について補足しておくと、MKL1はG-アクチンが直接結合することによって核移行が阻害され、標的遺伝子のプロモータに結合できないためにその転写活性化を阻害すること、一方、アクチン重合に伴ってG-アクチン量が減少すると、MKL1はアクチンから解離した後に核内に移行し、標的遺伝子の転写活性を促進することがこれまで知られている。
MKL1が調べられた結果、分化前まではMKL1はそのほとんどが核内に局在したが、分化誘導に伴ってアクチンファイバーが脱重合し、細胞内でのG-アクチンレベルが増加すると共に、MKL1が細胞質内にとどまるようになった。また、アクチン重合阻害剤である「Latrunclin A(LatA)」で処理することによって、細胞内のG-アクチンレベルが増加し、MKL1の核移行が阻害され、分化誘導剤を添加しなくてもPPARγの発現が誘導されることが見出されたのである(画像4)。LatAは単量体G-アクチンのATP結合部位近傍に1:1で結合し、アクチン重合を阻害する仕組みだ。
さらに、Gアクチンと結合できない変異型MKL1「MKL1-N100」を強制発現させた細胞では、野生型MKL1と異なり、LatA処理によってG-アクチンレベルを増加させてもMKL1は核内に移行し、PPARγの発現を抑制することも確認された(画像5・6)。これらのことから、アクチンファイバーの脱重合により増加したG-アクチンがMKL1の核移行を阻害することによって、PPARγの発現が直接誘導されることが明らかとなったというわけだ。つまりMKL1は核内ではPPARγの発現を抑える役割を持っていて、核から外に出ることでPPARγの発現が誘導されることになる。
|
|
|
|
|
G-アクチンとMKL1の相互作用がPPARγの発現に及ぼす影響。アクチン重合阻害剤のLatAを添加すると、G-アクチンレベルが増加し、MKL1の核移行が阻害され、分化誘導剤なしでもPPARγの発現が誘導される(画像4(左))。また、MKL1-N100を強制発現すると、G-アクチンと結合できないために、LatAを添加してもMKL1は核内に移行し、PPARγの発現が抑制される(画像5(中)・6(右)) |
||
さらに、DFATにおいてMKL1の発現を「RNA干渉法(RNAi)」(標的とするタンパク質のmRNA発現を特異的に抑制する方法)を用いて抑制すると、分化誘導剤がなくてもPPARγの発現が誘導され、脂肪細胞へと分化すること(画像7)、また、MKL1を発現抑制したDFATをマウス皮下に移植すると、体内においても脂肪細胞へと分化し、脂肪組織を形成することが判明(画像8)。
さらに、元々脂肪分化能を持たない「NIH3T3線維芽細胞株」においてMKL1の発現を抑制すると、PPARγの発現が誘導されることが見出された(画像9)。これらにより、アクチン細胞骨格により制御されるMKL1は脂肪分化のゲートキーパーとしての機能が明らかとなったのである。
また、脂肪分化においてPPARγと逆相関して、MKL1の発現が減少することが見出された。そこで、MKL1の発現制御にPPARγが関わっているという考えから、PPARγの発現が抑制されたところ、脂肪分化に伴うMKL1の発現減少は見られなかったという。一方、PPARγを強制発現させると、MKL1の発現が有意に減少したのである。これらのことから、脂肪分化過程においてMKL1とPPARγは相互に抑制し合う機構があることがわかったというわけだ。
以上の結果から、線維状のアクチンがバラバラになることにより増加したG-アクチンがMKL1と結合して核への移行を阻害することによってPPARγが発現し始め、そして増加したPPARγによってMKL1の発現が抑えられることで脂肪細胞へと終末分化するという、巧妙なメカニズムが存在することが明らかとなった(画像10)。今回の研究は、細胞の「形」の変化が分化を直接制御する分子メカニズムを解明したものであり、「細胞分化は特異的な転写因子の発現によって直接制御される」という、これまでの常識を覆す新たな概念だとしている。
画像10は、アクチン動態によるMKL1を介した脂肪分化制御メカニズム。RhoA/ROCKシグナルの不活性化によって増加したG-アクチンが、MKL1と相互作用することによってMKL1の核移行を阻害し、PPARγの発現を誘導する。PPARγはMKL1の発現を抑制することによって、さらに活性化し、脂肪細胞へと終末分化するという仕組みだ。
今回の発見によって、アクチン細胞骨格の変化が脂肪細胞の分化を誘導するという分子現象が明らかになったが、ほかの細胞種への分化においても類似のメカニズムが働いている可能性があり、幹細胞から特定の細胞への分化をこれまでより容易に誘導できる手段の開発が見込まれるという。また未分化な性質を持つ腫瘍細胞、つまりがん幹細胞を、アクチン動態を制御することで終末分化に導いて治療を行うことも理論的には可能であり、今後さまざまな応用が期待できるとしている。