東京医科歯科大学(TMDU)は2月3日、糖尿病に伴う血管内皮機能障害および血管新生能異常の原因が、細胞内のエネルギー産生を促進させる働きをもち、遺伝子情報をもとにタンパク質を作り出す効率を調節する分子「PGC-1α」が高血糖によって増加することによるものであることを突き止めたと発表した。
同成果は、同大 歯と骨のグローバルCOEおよび分子内分泌代謝学分野の澤田直樹特任講師(現 シカゴ大学准教授)、ハーバード大学のZolt Arany准教授、順天堂大学の田中里佳 准教授、徳島大学の佐田政隆 教授、東京大学らの共同研究グループによるもの。詳細は国際科学誌「Cell Metabolism」オンライン版に掲載された。
下肢切断にもつながる重傷下肢虚血は糖尿病患者の10~15%に認められる病態であり、有効な治療法の確立が求められている。これまでの研究から、糖尿病患者が下肢に虚血(当該部位に流れ込む動脈血の量が減少することで生じる局所の貧血)をきたし、重症化しやすい理由として、虚血に反応して新たな血液を作り血流回復させるための能力(血管新生能)が大きく減弱していることが関与していることが分かっていたが、その原因は不明となっていた。
また、「PGC-1α」は、糖尿病患者では肝臓にて、その量が持続的に上昇する結果、血糖値の上昇につながること、ならびに骨格筋ではインスリンの作用が減弱する原因にも関与することなどが報告されており、糖尿病の発症進展において重要な役割を担う可能性が示唆されていたが、血管の細胞における役割は分かっていなかった。
そこで今回研究グループでは、薬剤性(ストレプトゾシン)、食餌性(高脂肪食)、遺伝性(db/dbマウス、ob/ob マウス)による種々の糖尿病マウスを用いて検討を実施。その結果、それらすべてのマウスにおいて、血管内皮におけるPGC-1αの量が健常マウスに比べ約1.5~3倍に増加していることを確認したほか、2型糖尿病患者の血液から採取した血管内皮へと分化する力をもつ「内皮前駆細胞」でも、健常者に比べPGC-1αの量が増加していることを確認したという。また、内皮細胞に高濃度の糖を加えるとPGC-1αが増加したことから、糖尿病で内皮細胞のPGC-1αの量が上昇する主な原因が血液中の糖濃度によるものであることも突き止めたとする。
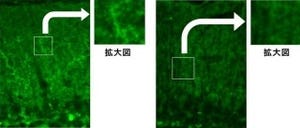
さらに、糖尿病マウスの内皮細胞および糖尿病患者の内皮前駆細胞を培養したところ、内皮細胞運動能の低下が確認されたことから、健常なヒトおよびマウスの内皮細胞にPGC-1αを強制的に増加させる操作(過剰発現)を行った結果、糖尿病の内皮と類似した運動能の低下を確認したとする。また、内皮でPGC-1αを過剰発現させた血管を培養したところ、内皮細胞の動きを止める細胞膜分子Notchが活性化され、新たな毛細血管を作り出す能力(血管新生)が抑制されることも確認したとするほか、PGC-1α欠損マウスの内皮では、内皮運動能が上昇し、強い毛細血管形成能が示されることも確認したという。
これらの結果を受けて、遺伝子操作を用いて血管内皮のPGC-1αを強制的に増加させたマウスを作成して研究を行った結果、糖尿病で認められる症状である「頸動脈の内皮を機械的に傷害した後の内皮再生速度低下」、「背中の皮膚に創傷を作成した後の治癒速度低下」、「大腿動脈摘出による下肢虚血後の血流回復能力低下」といった症状が確認されたという。また、血管内皮におけるPGC-1αの量を正常の3割程度に減少させたマウスを用いた実験では、糖尿病を発症させても糖尿病のないマウスとほぼ同様の健常な速度で創傷が治癒したほか、下肢虚血術後においても健常マウスと同等の正常な血流回復力を持っていることを確認したという。
今回の結果を受けて研究グループでは、糖尿病における血管新生異常は、重症下肢虚血に加え、心筋梗塞をおこした後の心機能悪化にも深く関与することが知られているが、今後、血管内皮のPGC-1αを標的とすることで、糖尿病血管合併症の新たな治療法開発につながることが期待されるとコメントしている。