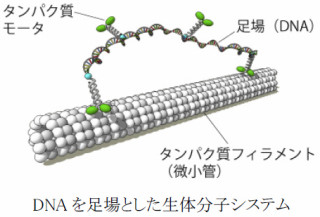
東北大学は1月21日、レールのように配置したカーボンナノチューブ(CNT)に分子モータータンパク質「キネシン」を固定化することで、生体分子の「微小管」を一定方向に輸送することに成功したと発表した(画像1)。
成果は、東北大 原子分子材料科学高等研究機構のAurélien Sikora助手、同・Javier Ramón-Azcón助教、同・Winfried Teizer Jr.主任研究者、同・大学院 環境科学研究科の珠玖仁 准教授、同大学院 工学研究科の梅津光央 准教授らの共同研究チームによるもの。研究の詳細な内容は、1月8日付けで「Nano Letters」オンライン版に掲載された。
細胞には核やミトコンドリアをはじめとしてさまざまな機能を持った器官があるが、これらの機能を維持するためには、それぞれの場所に適切なタンパク質を輸送する必要がある。この細胞内輸送で重要な役割を果たすのがキネシンだ。キネシンは、細胞内にレールのようにひかれた微小管に沿って移動することができる。このキネシンに小胞体などが結合することによって、細胞内においてさまざまな種類の分子の輸送が行われているというわけだ。
このような細胞内輸送システムをモデルとして、化学物質の合成や検出、精製などで微小な化合物を輸送するためのデバイス開発を目指した研究が行われている。これまで、キネシンをガラス基板などに固定化することで、ベルトコンベアーのように微小管を移動させることが可能であることは実証されていた。しかしこの方法には、微小管の輸送方向を制御することが困難という問題点がある。方向を制御するための手法として、化合物を流すための道(流路)を作り、電圧をかけて移動させる方法も提案されていたがポンプや電源を設置する必要があり、デバイスの小型化への障壁となっていた。
そこで研究チームは今回、微小管の輸送方向を制御するため、まず電極を配列化した基板の上で「多層CNT(MWCNT)」を固定化。その上で、MWCNTにキネシンを固定化するという手法を採用した。これにより、ポンプや電源を使わず、微小管の運動方向をCNTに沿って1次元的にガイドすることに成功したのである。
具体的には、電極に沿ったMWCNTを配列化するために「誘電泳動」が利用された。誘電泳動とは、交流電場中に置かれた微小物体が移動したり回転したりする現象のことをいう。交流電場の向きや周波数を制御することにより、物体の動きや配向をコントロールできるというわけだ。
まず化学修飾法と組み合わせて条件を最適化することにより、100μm間隔の電極間にMWCNTが固定化された(画像2)。さらにキネシンがMWCNT上に固定化。生体分子として「ローダミン」で蛍光標識した微小管が用いられ、ヒトなどの生体内で使われる化学エネルギー「ATP(アデノシン三リン酸)」が存在する溶液中において、微小管がMWCNTに沿って1次的に移動する様子が蛍光顕微鏡によりリアルタイムで計測された(画像3)。その結果、微小管の平均移動速度が秒速149±53nmであることがわかった。
輸送速度や移動方向制御のさらなる改善が進めば、新規超小型生体分子輸送システムが実現可能となることが期待できるという。これまで、生体分子の輸送システムは流路ユニットを組み上げる原理が主流であり、デバイス自体は小さくてもポンプや電気系統の付加が必須だった。同システムでは、ポンプや電源を外部に備え付ける手間が省かれることにより、従来のデバイスと比べて小型化することが可能になる。
今回の研究は、化学物質の合成や検出、精製など、異なる実験操作を同一チップ上に集積化する「Lab-on-a-chip」研究カテゴリーの可能性を広げる研究と位置付けることができるという。Lab-on-a-chipデバイスは、すでに核酸・タンパク質分析や細胞解析のツールが実用化している一方で、ポンプや電源の一体化など、課題となる開発すべき要素もあり、それらの研究が世界中で展開されているところだ。