東京医科歯科大学(TMDU)と科学技術振興機構(JST)の2者は10月30日、生体が消化管寄生虫感染に対して抵抗力を獲得する仕組みを調べ、2度目以降の感染では白血球の1種である「好塩基球」が効率的寄生虫排除に重要な役割を果たしていることを発見したと共同で発表した。
成果は、TMDU大学院 医歯学総合研究科 免疫アレルギー学分野の烏山一教授らの研究チームによるもの。研究はJST課題達成型基礎研究の一環として行われたもので、詳細な内容は米国東部時間10月28日付けで米科学誌「Journal of Experimental Medicine」のオンライン速報版に掲載された。
近年、先進諸国において寄生虫感染症は激減したが、地球全体で見ると熱帯・亜熱帯地域の開発途上国を中心として、今でも多くの人々が寄生虫感染症に罹患している。特に、消化管寄生虫の感染者は約20億人と推定されており、約2億人と推定されるマラリア患者数の10倍だ。小児期の消化管寄生虫感染は、貧血・栄養不良さらには知的・精神的発達障害をもたらし、感染者は就学や就労が困難になり、貧困から抜け出せない原因となっている。薬物による寄生虫駆除と共に、消化管寄生虫感染症を予防するための有効なワクチンの開発が必要とされている状況だ。
これまでの研究で、消化管寄生虫感染症を経験するとヒトの体に抵抗力ができて、2度目の感染では1度目に比べて効率よく寄生虫を排除できることがわかってきた。この抵抗力獲得の仕組みがわかれば、消化管寄生虫感染症に対する有効なワクチン開発に役立つものと期待されているが、その仕組みの詳細はわかっていなかったのである。
そこで研究チームは今回、腸に寄生する「鉤虫」のマウス感染症モデルを用いて解析を実施。その結果、2度目の感染時には「お腹の虫を皮膚で退治する」という予想外の仕組みによって、生体が寄生虫感染の拡大を阻止していることを究明した。
鉤虫は代表的な消化管寄生虫で、ヒトに感染するのは主として「ズビニ鉤虫」と「アメリカ鉤虫」の2種類だ。メスの成虫は体長10~12mm、体幅0.6~0.7mmで、オスの成虫はそれよりも少し小型だ(画像1・2)。熱帯地方を中心に約10億人が鉤虫に感染していると推測され、前者は主に中東、北アフリカ、インド、南ヨーロッパで見られ、後者は主にアメリカ大陸、サハラ砂漠以南のアフリカ、東南アジア、中国、インドネシアなどで見られる(画像3)。現在、日本国内で感染することはまれだが、戦前までは日本でも多数の症例が見られたという。
|
|
|
|
|
画像1(左):小腸壁に食いついて吸血している2匹の鉤虫(成虫)。 画像2(中):鉤虫の口部分。(引用元は、米国CDC Public Health Image Library)。 画像3(右):鉤虫感染症の流行地域。(引用元は、Hotez P. et al.(2005)Hookworm:"The Great Infection of Mankind". PLoS Med2(3):e67) |
||
メスの成虫は毎日何1000個もの卵(画像4)を産むため、大量の虫卵が糞便と共に体外に排出される。外界に出た虫卵は土中で孵化し、2回脱皮したのち感染幼虫(画像5)となる。さらに肺胞の壁を突き破って気管に入り、咽頭、食道、胃を経て最終目的地である小腸上部に到達して寄生し、腸管壁にとりついて吸血を行うのである(画像1)。そして小腸に到達した後に成虫となって産卵し、便と共に卵が体外に出て土中で孵化するという複雑な生活サイクルを繰り返す(画像6)。
この鉤虫の体内移動に呼応して、幼虫が侵入する際の皮膚のかゆみ、幼虫が肺を通過する際の胸痛・咳・喘鳴(ゼーゼー、ヒューヒュー)・喀血、消化管内の成虫が引き起こす腹痛・下痢・食欲不振・体重減少・貧血などが、感染者には見られるというわけだ。
|
|
|
|
|
画像4(左):鉤虫の卵。 画像5(中):鉤虫の幼虫(画像4と5の引用元は、米国CDC Public Health Image Library)。 画像6(右):宿主の体内を動き回る鉤虫のライフサイクル |
||
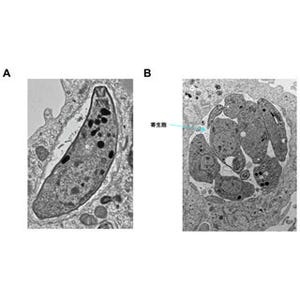
このように想像しただけで気分が悪くなってくる鉤虫だが、そのマウス感染症モデルが調べられた結果、2度目の感染では1度目の感染に比べて肺や小腸まで到達する幼虫の数が激減していることが判明した。それは、幼虫が侵入した皮膚内に閉じ込められている(画像7)ためであることが明らかとなったのである。
これまで知られていた「腸に到達した寄生虫を腸から排出する」方法、つまり、腸管の粘膜細胞がたくさんの粘液を分泌することによって、寄生虫はちょうどすべり台に乗った感じで腸管をすべりおちていって便と共に体外に排出されるという方法とは別に、寄生虫を感染開始部位である皮膚に留めて肺や消化管への感染の拡大を防止するという新たな生体防御メカニズムが存在することが判明したのである。
画像7が、皮膚の中に閉じ込められた鉤虫の幼虫の顕微鏡写真だ。1度目の感染では、皮膚から侵入した幼虫は即座に血管に入って肺へと移動するが、2度目の感染では、この写真にあるように多数の血球細胞(青色)が集まって来て幼虫(オレンジ色)を取り囲んで皮膚内に留め、身動きが取れなくなった幼虫は肺や腸に到達することができないようになる。
さらに詳しく調べたところ、血球細胞の中でも好塩基球が重要で、寄生虫の侵入を察知すると「サイトカイン」(細胞間でやり取りされる多様な生理活性を持つタンパク質の1種)の1種の「インターロイキン(IL)-4」をたくさん分泌すること、さらにそのIL-4が白血球の1種の「マクロファージ」に作用して、寄生虫の動きを鈍らす物質の「アルギナーゼ1」を分泌させることで、寄生虫を皮膚内に封じ込めること(画像8)が明らかとなった。
また、生体内から好塩基球を取り除く操作をすると、寄生虫が皮膚に捕捉されずに多数の寄生虫が肺を通過するため、肺の出血や組織破壊がひどくなることも確認されている。つまり、好塩基球は寄生虫を皮膚に留めることで、寄生虫感染の拡大を防ぎ、寄生虫による組織破壊から肺を保護するという大切な役割を果たしていることがわかった。
なお好塩基球は白血球の1種で、割合としては約0.5%を占めるだけの極少血球細胞だ。長年その存在意義が不明だったが、最近の研究によりアレルギーの発症や寄生虫に対する生体防御に重要な働きをしていることが次第にわかってきている。マクロファージも白血球の1種で大食細胞とも呼ばれ、異物や死細胞などを取り込んで処理する掃除屋の役割を担う。1型と2型に大別され、前者は結核など細胞内寄生細菌の排除に、後者は寄生虫の排除や組織修復に重要な働きをしているといわれている。
今回明らかにされた、消化管寄生虫の感染を好塩基球が中心となって皮膚で防御するという仕組みをうまく応用することで、消化管寄生虫に対する効果的なワクチンの開発が進むものと期待されるという。また、寄生虫排除反応とアレルギー反応は表裏一体の関係にあることを鑑みると、好塩基球による寄生虫排除の仕組みをさらに詳しく調べることで、アレルギー疾患の発症メカニズムの解明が促進されることが期待されるとしている。