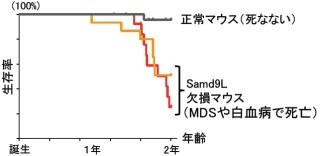
大阪大学(阪大)と国立遺伝学研究所(NIG)は10月10日、大阪府立大学、国立国際医療研究センター(NCGM)、東レリサーチセンター、放射線医学総合研究所(NIRS)、同志社大学、立命館大学との共同研究により、生物が放射線からDNAを守る新たな仕組みを突き止めたと共同で発表した。
成果は、阪大の髙田英昭助教(元・NIG研究員)、NIGの前島一博教授、同・花房朋研究員、大阪府立大の森利明准教授、NCGMの志村まり室長、東レリサーチセンターの飯田豊部長、NIRSの石川顕一研究員、同志社大の吉川研一教授、立命館大の吉川祐子客員教授らの共同研究チームによるもの。研究の詳細な内容は、日本時間10月10日付けで米オンライン科学誌「PLoS ONE」に掲載された。
ヒトの体を構成する1個1個の細胞の中に収められているDNAは、全長約2メートルにもおよぶ。平均的な日本人の身長よりも遙かに長いDNAが、どうして細胞の中に収まっていられるかというと、とても細いからであり、直径はわずか2nm、つまり100万分の2mmしかない。
またDNAはグシャグシャな状態で細胞の核に押し込められているわけではなく、タンパク質「ヒストン」に巻かれて、線維構造の「ヌクレオソーム」を形成した状態で収められている。細胞核中では、このヌクレオソーム線維が塊を形成し、ほかのタンパク質と共に「クロマチン」として収められているというわけだ。
そうした、細い糸であるDNAからヌクレオソーム、クロマチン、そして細胞核と段階を踏んで表示したのが画像1だ。わずか直径2nmのDNA(1段目)は糸巻きの役割をするヒストンに巻かれて、直径約11nmのヌクレオソーム(2段目)を作る。このヌクレオソームもきちんと畳まれて核の中に種運用されているのかと思いきや、最近になって不規則に折りたたまれた状態でクロマチン(3段目)が形成されて細胞内に収められていることが、研究チームの前島教授らによって確かめられたというわけだ。
地球上の生物は一部はDNAを持たず、RNAしかないものもいるが、基本的に前述した構造を持つ。そんな細くてはかなげなDNAにとっての大敵の1つが、その切断を引き起こし、最悪の場合はそのDNAを収納した細胞が1つが死ぬだけでなく、生物個体そのものの死にも関わってくる放射線である。
放射線というと、福島第一原子力発電所の事故で漏れた放射性物質に近づくと浴びてしまうというイメージが今は強いかと思うが、実は微弱ながら自然環境において放射線は常時放たれており、地球上の生物は平均して毎年約2.4mSvの放射線を浴びているのである(もちろん環境によって増減する)。
放射線とは、ウランやプルトニウムなどを初めとする放射性物質がα崩壊、β崩壊、γ崩壊それぞれに伴うα線(質量4のヘリウム原子核)、β線(電子)、γ線の3種類に加え、X線、中性子線などのことをいう。これら放射線はエネルギーが強いため、前述したようにDNAの切断を引き起こし、DNAを切断された細胞の数が多くを占めると、その生物は死に至るというわけだ。
しかし、前述したように天然の放射線を微弱とはいえ、ヒトも含めてあらゆる生物は浴びているわけだが、防御機構がない限り、DNAは損傷を受ける一方のはずである。そこで以前から推測されていたのが、DNAが集まって凝縮している状態を保つのは、放射線などの環境ストレスからゲノム情報を守るため、というものだ。画像2はそれを表した模式図だが、凝縮していない時のDNA(赤線)は放射線によって発生するヒドロキシルラジカル(活性酸素、画像中の「・OH」)や抗がん剤(画像中の青丸)による損傷を受けやすいが、凝縮している時には、DNAはこれらから保護される。
実際、DNAの凝縮とDNA損傷の関係について調べた研究が過去にも報告されている。しかしながら、損傷を加えず長いDNAを扱う方法やDNA損傷を高感度かつ定量的に検出するよい方法がなかったことから、これまでは厳密な検証ができていなかったというわけだ。
そこで高田助教と前島教授を中心とする研究チームは今回、DNAの凝縮状態を自在に変化させることができ、さらにDNA損傷を定量的に検出できるシステムを構築したのである。DNA損傷を定量的に解析することがこれまで困難だった大きな理由は、「ピペッティング」などの実験操作により、DNAに物理的損傷が加わってしまい、放射線の影響のみを厳密に定量することができなかったからだ。
そこで研究チームは今回、DNAが含まれる核をヒトのがんの培養細胞である「HeLa細胞」からそのまま取り出し、薄いカバーガラスの上に貼り付けるという方法を採用した。DNAは核の中で保護されており、核を貼り付けたままのカバーガラスをさまざまな反応溶液に浸すことで、実験操作に基づくDNAへの物理的損傷を避けるようにしたのである(画像3)。
核の中のDNAの凝縮状態を変化させるために、二価陽イオンである「マグネシウムイオン(Mg2+)」が用いられた。DNAの構造単位に含まれるリン酸基は負電荷を帯びているため、リン酸基の負電荷同士には反発し合う力が働き、DNAを凝集しにくくさせている。そこで、Mg2+を加えることによって、DNAに含まれる負電荷を打ち消し、密に凝縮した状態を誘導したというわけだ。
一方、これにEDTAという薬剤を加えると、マグネシウムイオンが取り除かれて陽電荷が打ち消され、DNAの負電荷が元に戻り、DNAは分散する(画像3)。なおクロマチンが脱凝縮すると体積が拡大するが、DNA切断を測定する際には、単位体積当たりの切断を測定するため、DNAの凝集状態がそろえられた。なお冒頭で説明したように、実際にはDNAは核の中でヒストンやほかのタンパク質と共にクロマチンを作っている(画像1)。
このように、マグネシウムイオンの濃度が異なる溶液にカバーガラスに貼り付けた核を移すことによって、クロマチンの凝縮状態を変化させた核が用意された。それにγ線を照射し、DNA切断がどのくらい起こっているかが「TUNEL(Terminal deoxynucleotidyl transferase dUTP Nick End Labeling)アッセイ」によって検出されたのである。
なおTUNELアッセイとは、DNAの2本鎖切断が生じた部位のDNAの3'末端にヌクレオチドアナログである「EdUTP」を酵素反応で取り込ませ、DNAの損傷部位に取り込まれたEdUTPは蛍光標識されえた試薬と反応することをいい、蛍光顕微鏡でDNA損傷を蛍光シグナルとして検出することが可能になる。
画像4が、0Gyと5Gyの放射線を照射した時のDNA損傷がTUNELアッセイによって検出さた結果を示したもの。5Gyの放射線を照射すると、クロマチンが凝縮していない時には明るいDNA損傷のシグナルが検出されるが、凝縮している時にはほとんど検出されない。スケールバーは10μmを示す。
DNA切断は蛍光色素のシグナルとして検出されることから、それを高性能CCDカメラで測定。実験操作を通じて、核はカバーガラス上に保持されたままなので、作業過程による物理的なDNA損傷を最低限に抑えることに成功したのである。
そしてDNA損傷を定量的に解析した結果は、驚くべきものだったという。DNA損傷はクロマチンの凝縮状態の違いに非常に敏感だったのだ。細胞の間期の核における凝縮状態では、凝縮していない状態に比べて16倍もの放射線耐性を得ることができたのである。細胞の分裂期のきわめて高度に凝縮した状態のクロマチンでは、凝縮していない状態に比べて50倍もの放射線耐性を得ることができたとした。
そこで疑問として浮かんでくるのが、なぜクロマチンが凝縮していると、DNA損傷を抑えることができるのか、という点だ。放射線によるDNA損傷の主な原因は、放射線によって水分子が開裂することにより発生する活性酸素の1種の「ヒドロキシルラジカル(・OH)」だと考えられている。ヒドロキシルラジカルは寿命は100万分の1秒と短いが、非常に強力な酸化作用を示し、DNAをはじめとする生体分子に損傷を与えるのである。
実際に、ラジカルの発生を抑制するラジカルスカベンジャーの存在下では、クロマチンが凝縮していなくても(分散していても)、DNA損傷はほとんど検出されなかったという。ヒドロキシルラジカルは短命であることから、DNAと離れた場所で発生してもDNAに損傷を与えることは不可能だ。もし、クロマチンが凝縮していると、DNAの周囲に水分子が少なくなるため、放射線を照射した時にDNA周辺で発生するヒドロキシルラジカルの数が少なくなる。これが、クロマチンが凝縮するほど高い放射線耐性が得られる理由だと考えられるとした。
クロマチンが凝縮することでDNAを保護することができるのは放射線(γ線)からだけではない。重粒子線がん治療装置(Heavy Ion Medical Accelerator in Chiba:HIMAC)を用いて間期核のクロマチンに対して重粒子線を照射したところ、クロマチンが凝縮することでDNA損傷を抑制することが確認されたのである。
また、抗がん剤として用いられている「シスプラチン」(DNAと結合し、DNA分子間もしくは分子内で架橋を形成することでDNA複製を阻害し、細胞増殖を停止させる)のDNAへの結合量を誘導結合「プラズマ質量分析計(ICP-MS)」(試料に含まれる元素をプラズマによりイオン化し、質量分析計により微量元素も定量できる装置で、今回は細胞中のシスプラチンに含まれる白金を定量)によって調べたところ、クロマチンが凝縮することでシスプラチンのDNAへの結合量が減少することが判明。このように、クロマチンが凝縮することでDNA損傷を防ぐという性質は、放射線に限ったものではなく、クロマチンが持つ一般的な性質であることが見出されたのである。
間期の核内でもクロマチンはある程度凝縮した状態を保っているが、今回の研究によって、その生物学的意義が明らかにされた。生物は、DNAを凝縮させることで、遺伝情報であるDNAが損傷を受けることを防ぐ仕組みを備えていたのである。
なお生物には損傷したDNAを修復する機構も備わっているが、生物進化の初期のDNA修復機構が未発達な段階では、DNAを凝縮させて環境ストレスから守ることは特に大きな利点を持っていたと想像されるとした。また、真核生物では次世代に伝える重要な遺伝子情報を安全に維持するために、この仕組みを役立てていると考えられるという。例えば、私たちヒトの卵母細胞は約40年もの間、減数分裂の途中で停止しており、DNAを染色体の状態で高度に凝縮した状態に保っているのである。
今回の成果から、新たながん治療法を確立するためのヒントも得られたという。クロマチンの凝縮をゆるめることで、がん治療に用いられている重粒子線や抗がん剤であるシスプラチンに対するDNAの感受性が増加することがわかったからだ。このことを利用して、クロマチンの凝縮をゆるめる働きがある「ヒストン脱アセチル化酵素阻害剤(TSA)」などを用いてがん細胞のクロマチンの凝縮をゆるめ、従来行われてきた放射線、重粒子線や抗がん剤を用いたがん治療の効率を飛躍的に向上させることが期待されるとした。