理化学研究所(理研)は10月9日、腰椎椎間板ヘルニアコンソーシウム、香港大学、フィンランド・Oulu大学の協力を得て、軟骨の「細胞外基質」の代謝に関わる遺伝子「CHST3」が「腰椎椎間板変性症(LDD:Lumbar Disc Degeneration)」の発症に関与していることを発見したと発表した。
理研 統合生命医科学研究センター 骨関節疾患研究チームの池川志郎チームリーダー、同・唐杉樹研修生(現・熊本大学整形外科特任助教)および、慶応大学整形外科の千葉一裕準教授(現・北里研究所病院教授)、富山大学整形外科の川口善治准教授らを中心とする腰椎椎間板ヘルニアの専門医集団で構成された腰椎椎間板ヘルニアコンソーシウムとの共同研究チームによる成果だ。研究の詳細な内容は、日本時間10月9日付けで科学誌「The Journal of Clinical Investigation」オンライン版に掲載され、後ほど印刷版にも掲載される予定だ。
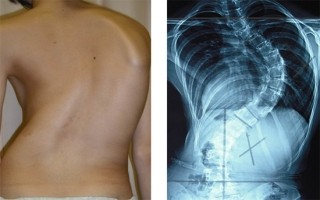
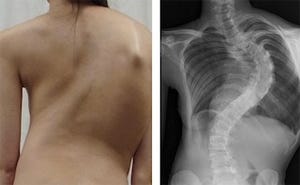
LDDは、腰椎の椎間板の老化に伴う変性によって発症する疾患の総称だ。骨・関節の疾患の中で最も発症頻度の高い疾患の1つで、腰痛症や腰椎椎間板ヘルニア(LDH:Lumbar Disc Herniation、画像1・2)もLDDが起因となって発症する。腰痛症の年間有病率は30%、生涯罹患率は80%ともいわれている。痛みにより日常生活動作が障害されて患者個人のQOLが低下し、医療上の問題だけでなく労働生産性の低下など、社会的な問題も生じている状況だ。しかし、その発症のメカニズムは実は現時点で不明で、予防法や根本的な治療法の開発が望まれているところである。
過去の疫学研究などからLDDは、環境的な要因と遺伝的な要因の作用により発症する多因子遺伝病であることは判明済みだ。骨関節疾患研究研究チームは、LDDの発症に関与する原因遺伝子を特定し、その働きを解明しようと研究を続けており、これまでに「CILP」や「COL11A1」、「THBS2」などのLDHの原因遺伝子の同定に成功している。しかし、LDDの原因や病態を解明するためには、さらなる遺伝子の同定が必要だ。そこで共同研究チームでもって、新たなLDDの発症に関与する原因遺伝子の同定に挑んだのである。
骨関節疾患研究チームは、多段階の「ゲノムワイド相関解析(GWAS:Genome-Wide Association Study)」を用いて、ゲノム全体から原因遺伝子の存在する領域の絞り込みを行った。LDHはLDDの一部、進行した重度のLDDと考えられている。そのため、今回の研究ではLDHとLDD患者から採取したDNAサンプルが用いられた。
まず、第1段階として腰椎椎間板ヘルニアコンソーシウムにより収集された日本人のLDH患者366人と対照者3331人のDNAサンプルを用いてGWASを行い、ヒトのゲノム全体をカバーする55万個の「一塩基多型(SNP:Single Nucleotide Polymorphism)」が調べられた。ヒトゲノムは30億塩基対のDNAからなるとされているが、個々人を比較するとその内の0.1%の塩基配列に違いがあると見られており、それが遺伝子多型である。そして遺伝子多型の内、1つの塩基がほかの塩基に変わるもののことをSNPといい、遺伝子多型は遺伝的な個人差を知る手がかりとなるが、その多くはSNPなのである。
次いで第2段階として、GWASでLDHと強い相関を示した上位1500個のSNPに対して、独立した日本人LDH患者544人と対照者1万5800人を用いて相関解析が行われた。さらに第3段階として、第2段階でLDHと強い相関を示した上位10個のSNPに対して、別の日本人LDH患者242人と対照者622人、および中国人のLDD患者572人と対照者776人のDNAサンプルを用いて相関解析を実施。
そして第4段階として、第3段階でLDDと最も強い相関を示した10番染色体上の1つのSNP「rs1245582」に対して、別の中国人のLDD患者572人と対照者776人、およびフィンランド人のLDD患者399人と対照5035人のサンプルを用いて相関解析が行われた。これら4段階の解析の結果を統合したところ、このrs1245582の「P値」が非常に低く、極めてLDDと相関が高いことがわかった(画像3)。なおP値とは、統計学的な指標のことをいい、偶然にそのような事象が起こる確率を指す。この値が低いほど相関が高い(相関は、偶然ではない)と判定できるのである。
画像3は腰椎椎間板ヘルニアの相関解析で発見された10番染色体上のrs1245582の相関。オッズ比とは、相関の大きさ、リスク多型の影響力の指標を指す。リスク多型を1つ持つごとにLDD発症リスクが1.20倍に高まる。全統合とは、GWASと再現解析の結果をMantel-Haenzel 法によるメタ解析で統合したもの。
また、共同研究機関である香港大学のYou-Qiang Song助教授らは、若年発症のLDD患者を含む中国人の家系、126人18家系についてゲノムワイド連鎖解析を実施。ヒトの1-22番染色体上である間隔で設定されている419個のゲノム上のマーカーが調べられ、その結果、LDDと強い関連性を示すマーカー「D10S569」が、rs1245582と同じ10番染色体上で発見された。
2つの異なった遺伝学的手法で同一の領域が示されたことから、この領域にLDDの発症に関与する原因遺伝子が存在することが強く示唆された形だ。データベースを調べると、この領域には遺伝子「CHST3(carbohydrate sulfotransferase3)」が存在していた。CHST3は、「コンドロイチン硫酸」など、軟骨の細胞外基質の代謝に関係する酵素を作る遺伝子である。
CHST3遺伝子領域内の網羅的な解析も行われ、rs1245582とほぼ「完全連鎖」するSNPが4個存在し、LDDに対してrs1245582と同程度の強い相関を示すことがわかった。完全連鎖とは、2つのSNPがゲノム上で極度に近接していると、その間での組換え確率は低くなり、見かけ上2つのSNPが常に1組となって遺伝する状態をいう。
これら4個すべてのSNPの位置について詳しい調査が行われ、その内の「rs4148941」と「rs4148949」の2つがメッセンジャーRNA(mRNA)からタンパク質の合成過程である「翻訳」を抑制する「マイクロRNA」が結合する配列に存在していた。これら2個のSNPに対してLDD患者1930人と対照者2136人のDNAサンプルを用いて相関解析が行われ、その結果、rs4148941とrs4148949のP値はいずれも低く、非常にLDDと強い相関が認められたのである。
LDDの主病変部である組織(軟骨、椎間板、骨)でのCHST3の遺伝子発現パターンが調べられたところ、これらすべての組織で高く発現していることが確認された(画像4)。また、細胞株を用いてCHST3のmRNAの量も調べられ、その結果、rs4148941の「疾患感受性アレル」を持つ細胞では、マイクロRNAの存在下でmRNAが減少することが発見された(画像5)。SNPには通常2つのアレル(対立遺伝子)が存在するが、正常人と比べてある疾患の患者が持っていることが多いアレルを疾患感受性アレルという。このアレルを持っていると疾患にかかりやく、つまり疾患になるリスクが高くなるのである。
なお画像5は、マイクロRNA(miR-513a-5p)存在下におけるCHST3 mRNA量に対する2つのSNPの影響を表したグラフ。「ルシフェラーゼアッセイ」を用いた遺伝子発現量の評価だ。マイクロRNAの存在下ではrs4148941のAアレルを持った場合にmRNA量が有意に減少している。SNPのrs4148949は発現に影響しない。ルシフェラーゼアッセイとは、DNAからmRNAが合成される過程である「転写」が正常に行われているどうかを確認するため、目的のDNA配列の下流にある生物発光酵素であるルシフェラーゼを導入し、そのルシフェラーゼタンパク質の検出によって転写反応の活性化を測定する手法のことだ。
|
|
|
|
画像4(左):さまざまなヒト組織でのCHST3遺伝子の発現量。関節軟骨、骨、椎間板に著しく高く発現している。 画像5(右):マイクロRNA(miR-513a-5p)存在下におけるCHST3 mRNA量に対する2つのSNPの影響 |
|
さらに、ヒト椎間板組織から抽出したmRNAが調べられ、その結果、rs4148941の疾患感受性アレルを持つ椎間板組織のCHST3のmRNAが減少していることが発見された(画像6)。これらの実験結果からrs4148941の疾患感受性アレルを持つとマイクロRNAの機能を介してCHST3のmRNAが不安定となり、その量が減少することがわかったのである。
一方、rs4148949でも同様の実験が行われ、するとmRNAに影響がないことが確認された。つまり、LDDの発症に関与するSNPはrs4148941であると考えられるのである。さらに詳細な解析が行われ、rs4148941の疾患感受性アレルを持つと、LDD発症のリスクが1.31倍高まることがわかった(画像7)。
|
|
|
|
画像6(左):ヒト椎間板組織(繊維輪、軟骨、髄核)においてrs4148941のCHST3遺伝子の発現に対する影響。CHST3mRNAの相対的発現量による評価。rs4148941のAアレルを持つとCHST3遺伝子の発現が減少する。Aアレルを持つとCHST3タンパク質量が低下すると予測された。 画像7(右):CHST3遺伝子の3'非翻訳領域のSNP(rs4148941)の相関 |
|
複数の人種においてLDDに関連する遺伝子を発見し、その機能異常を解明した今回の発見によりLDD、および椎間板ヘルニアの原因や病態の解明が急速に進展することが期待できる。今後、CHST3の機能解析を続け、LDD発症に関わる新たな経路をさらに詳しく調べることで、ゲノム・分子レベルにおいてLDDの病態の理解が進み、新しいタイプの治療薬の開発が可能になることが期待できる。理研 骨関節疾患研究チームは、今後も国際協力研究を展開し、新たな疾患に関与する原因遺伝子やこれまでに判明している遺伝子の情報を組み合わせてLDDの診断・予測モデルを作成することによって、LDDの発症や進行のリスクをより簡便、正確に予測できるようなシステムを作ることを目指す。