科学技術振興機構(JST)、大阪大学(阪大)の2者は、「人工細胞」を用いて膜タンパク質を実験室で「進化」させることに成功したと共同で発表した。
成果は、阪大大学院 情報科学研究科の四方哲也 教授、同・工学研究科の松浦友亮 准教授らの研究チームによるもの。研究はJST課題達成型基礎研究の一環として行われ、詳細な内容は米国東部時間9月30日付けで米科学雑誌「米科学アカデミー紀要(PNAS)」に掲載された。
遺伝子操作などのバイオ技術が開発された当初、タンパク質のある特定の部位に変異を導入する「部位特異的変異導入法」により、自由にその機能を改変することや活性を強化できるようになるとの期待が高まった。ところが現実には、タンパク質内部の予想できない複雑な相互作用により、ある特定の部位への変異導入がタンパク質のほかの部位へ影響を与えることになってしまい、目的とする機能への改変や活性の強化ができないばかりか、活性を大きく損なうことが少なくなかったのである。生命の重要な要素であるタンパク質は、人類が予想した以上に複雑だったというわけだ。
そうした状況の中、1990年代になり、部位特異的変異導入法とは、まったく異なる手法として「進化分子工学的手法」が考案された。進化分子工学的手法は、ダーウィン進化を実験室で模倣することにより、変異と選択のステップを繰り返し行うことで生体高分子の性質を改変・改良していくという方法だ。
同手法は、遺伝子へのランダムな変異導入によって作られた10万~100万種類のタンパク質を用意し、それぞれの性質に沿った選択を行わせることにより、目的の性質を持つタンパク質を得ることができるというものである。こうして得られたタンパク質に対して、さらに変異と選択を適用することにより、その目的に沿った性質を強化していくことができる仕組みだ。
この進化分子工学的手法は、10万~100万種類の翻訳されたタンパク質とその遺伝子をそれぞれ個別に対応させる必要がある。このタンパク質とその遺伝子を個別に対応させるための方法として考え出された手法の1つが、細菌「ファージ」に感染するウイルスを用いる「ファージディスプレイ法」だ。また、タンパク質の翻訳を完全に終了させず、細胞小器官「リボソーム」とタンパク質とメッセンジャーRNA(mRNA)の複合体を用いる「リボソームディスプレイ法」もその1つである。こうした進化分子工学的手法は可溶性タンパク質に多く適用され、産業上有用なタンパク質・酵素の創出などに貢献すると共に、タンパク質の機能発現メカニズムの解明にも寄与してきたのである。
その一方で、細胞がコードする遺伝子の20~30%が膜タンパク質だ。膜タンパク質は脂質二重膜である細胞膜表面に付着していたり、細胞膜自体を貫通していたりして脂質二重膜と相互作用するタンパク質である。これらの膜タンパク質には重要な働きを持つものが多い。細胞外の物質が細胞表面に露出した膜タンパク質に結合することにより、外部からのシグナルを細胞内部に伝達したり、細胞外のある特定の物質だけを内部に特異的に取り込んだりするといった作用を持つのだ。
またインフルエンザやHIVなどウイルスの多くは、細胞表面のある特定の膜タンパク質に吸着することにより細胞に感染を開始することなどから、製剤のターゲット分子の50%以上は膜タンパク質であるといわれている。しかし、ファージディスプレイ法やリボソームディスプレイ法では、異種タンパク質の発現量が少ない、膜タンパク質の発現によってファージが増殖できなくなる、膜タンパク質は脂質二重膜に組み込まれていない状態では不安定で脂質二重膜に組み込まれていない状態での選択操作はできない、などの問題点があった。そのため、これまでに膜タンパク質は、進化分子工学の標的タンパク質としてほとんど扱われてこなかったのである。
膜タンパク質を実験室で進化させるためには、まず合成することが必要だ。一方、膜タンパク質は細胞内での発現量が少なく疎水領域が多いため、調製中に凝集体を形成しやすい、大量発現によって細胞毒性を示す、膜組成の違いによって異種発現タンパク質が機能しないなど、試料調製を困難にする性質も持つ。そこで研究チームは、細胞サイズのリポソームの内部にタンパク質合成に必要なものをすべて埋め込んだ人工細胞を用いて、膜タンパク質の合成を行うという手法を検討。そしてこの人工細胞内で、遺伝子から膜タンパク質をわずか数時間で合成することに成功したというわけだ。
合成された膜タンパク質は人工脂質膜に組み込まれることで、初めてその機能を発揮する。次に研究チームは人工脂質および人工細胞内の分子を工夫し、膜タンパク質が脂質膜に組み込まれ、機能を発揮する条件を探し出した。
さらに、遺伝子に人工的に変異を導入し、100万種類の多様な遺伝子の集団を作成。次に必要となるのが、膜タンパク質の機能を進化させるため、膜タンパク質の遺伝子の集団から機能の高い膜タンパク質の遺伝子を選択する技術である。研究チームは、機能の高い膜タンパク質を発現した人工細胞がより強い蛍光強度を示す実験系を確立。蛍光セルソーターを用いて選択してくることに成功したのである。この人工細胞を使って膜タンパク質を実験室で進化させる技術は、「リポソームディスプレイ法」と命名された。
ちなみに人工細胞の定義だが、まだ明確にはなされていないものの、一般的には細胞の機能の一部を人工的に再構成した細胞状の構造を人工細胞と呼ぶことが多い。今回の人工細胞は、細胞の機能の内、タンパク質合成に必要なものをすべて持ち、その系による遺伝子翻訳、脂質二重膜による微小区画構造が人工的に再構成されている。
リポソームディスプレイ法の有効性を示すため、研究チームは生体膜に穴を開ける膜タンパク質「α-ヘモリシン(画像1)」の実験室進化を実施。まず、リポソーム内部にα-ヘモリシンの遺伝子とタンパク質合成に必要な全因子を入れ、人工細胞を構築することからスタート。この時、遺伝子の濃度を十分に低くすることで人工細胞のほとんどが遺伝子を含まないようにし、一部の人工細胞のみが1つの遺伝子を含むように調整された。2つ以上の遺伝子が入ってしまうと、高活性の遺伝子と低活性の遺伝子が混ざり合って、高活性の遺伝子活性が打ち消されてしまうからだ。
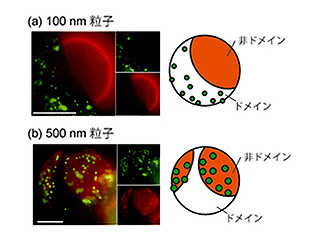
画像1が、リポソームディスプレイによるα-ヘモリシンの「進化」を表した模式図だ。α-ヘモリシンの遺伝子に人工的に変異を導入し、その遺伝子をリポソーム内部に封入すると、α-ヘモリシンのタンパク質が合成される。合成されたタンパク質はリポソームの脂質膜に刺さり、小さな穴を開ける仕組みだ。穴の数が多いほどより多くの蛍光物質が流入するので、それを利用してより多くの蛍光物質を流入させたリポソームを分取し、内部のDNAを取り出して同様の作業を繰り返すと、穴を形成しやすい遺伝子が得られるのである。
左下のグラフは実際に蛍光輝度と頻度を表したヒストグラムだ。遺伝子が入っていないリポソームは暗く、遺伝子が入っているリポソームは明るいことがわかる。明るいリポソームの中でも特に蛍光輝度が高いリポソームが分取される形だ。中央下のグラフは今回の研究によって得られた「進化」型と野生型の膜タンパク質活性が測定された結果。右下の図は進化型のα-ヘモリシンを解析した結果、変異が見つかった部位を赤色で示したもの。ちょうど脂質膜に組み込まれる部分に変異が集中している様子が見られる。
このようにして作成した人工細胞を37度で反応させ、遺伝子からタンパク質を合成すると、前述したようにα-ヘモリシンの活性に応じて脂質膜に穴が形成されるので、次に、外部から蛍光物質を与えるとα-ヘモリシンの活性に応じて蛍光物質の取り込み量が増えるシステムが構築された。
蛍光物質はα-ヘモリシンの穴を通してのみ人工細胞の内部に入り、穴の数が多い人工細胞ほどより多くの蛍光物質を取り込む。蛍光物質は人工細胞の内部で巨大分子と共有結合するようにシステムが構築されているので蛍光物質は人工細胞の内部には流入しても、外部へ漏れ出さない。これにより、蛍光物質が一方通行で時間と共に蓄積していくため、人工細胞の蛍光を高感度に検出できるというわけだ。
最も多くの蛍光物質を取り込んだ人工細胞が蛍光セルソーターで選択・分取され、分取された人工細胞からは高機能型の遺伝子が得られ、その遺伝子を用いて再度人工細胞を作製して同様の作業を繰り返す。これらの作業を20回繰り返された結果、野生型よりも約30倍も脂質膜に穴を開ける能力の高い変異体の取得に成功したのである。
この方法は、α-ヘモリシン以外の複数の膜タンパク質でも合成可能で、それらのタンパク質が人工脂質膜に組み込まれることも示しており、このことはリポソームディスプレイ法がさまざまな膜タンパク質の実験室進化に利用できる可能性を示唆しているという。
リポソームディスプレイ法の最大の特徴は、従来のディスプレイ技術では扱えなかった膜タンパク質を対象にできる点だ。同手法を用いれば、さまざまな機能の改変、もしくはより高機能化した「便利な膜タンパク質」を構築することが可能になるため、高性能バイオセンサの開発などにも寄与する可能性があるとする。
そのほかにも膜タンパク質に強く結合することによりその機能を阻害する新たな薬を発見できる可能性など、多方面への波及効果が期待されるという。研究チームではすでにリポソームディスプレイ法に関する特許出願を済ませており、今後、産業界と連携して膜タンパク質の産業利用など多方面への展開が期待されるとしている。