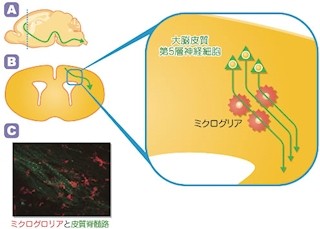
九州大学(九大)は9月24日、「大脳皮質体性感覚野」に分布する「ミクログリア」は「内在性分子時計」を持ち、ミクログリアに特異的な「リソソーム性プロテアーゼ」である「カテプシンS」の発現を制御していることを明らかにし、さらにミクログリアより分泌されるカテプシンSが皮質ニューロンの樹状突起「スパイン」の密度ならびにシナプス活動の、夜間増大し昼間減少するという日内変化に関与していることを突き止めたと発表した。
成果は、九大大学院 歯学研究院の中西博教授らの研究チームによるもの。研究は科学技術振興機構(JST)戦略的創造研究推進事業チーム型研究(CREST)の一環として行われ、詳細な内容は現地時間9月25日付けで英オンライン総合学術誌「Scientific Reports」に掲載された。
中西教授らの研究チームは、これまでに、感覚伝導路を介して末梢の感覚器から直接的に投射を受けている脳部位である大脳皮質体性感覚野に分布するミクログリア(中枢神経のグリア細胞の1種で、脳脊髄に存在し、脳内免疫機能を担う)の突起が、昼間よりも夜間の方が有意に長く、また突起の分岐点も夜間の方が有意に多く、ミクログリアと皮質ニューロンのスパイン(興奮性シナプス入力を受けるニューロン樹状突起の刺状隆起のこと)との接触率も夜間の方が昼間よりも有意に大きいことを見出していた。
また、ATP(アデノシン三リン酸)受容体の1種で、ミクログリアの突起伸展に関与する「P2Y12受容体」発現の日内変化がミクログリア突起構造ならびにスパインとの接触率の日内変化に関与することも解明。さらに、昼夜におけるニューロン活動の日内変化はスパイン密度の日内変化に基づくことが知られているが、スパイン密度ならびにシナプス活動性の日内変化も脳内ではミクログリア特異的に発現するP2Y12受容体が制御していることを明らかにしてきた。
こうしたスパイン密度の日内変化は、ミクログリアによる貪食(どんしょく)除去により生じる可能性が考えられるが、ミクログリアによるスパイン貪食は確認できていないという。貪食除去以外にも「細胞外マトリクス」(細胞と共に生体組織を構成する細胞の外に存在する高分子群のこと)の分解・修飾によってスパインの退縮ならびに成熟が引き起こされることが知られている。
このような背景から中西教授らは今回、ミクログリアが分子時計を有している可能性について、またミクログリア分子時計の支配下にあるプロテアーゼが皮質ニューロンのスパイン密度ならびシナプス活動の日内リズム形成に関与する可能性についての検討を行った次第だ。
大脳皮質から経時的に単離したミクログリアにおける「時計遺伝子」(概日リズムを司る遺伝子群のこと)の発現量の日内変化を解析した結果、ミクログリアは内在性分子時計(概日リズムを司るタンパク質により構成される転写、翻訳に依存したフィードバックループのこと)を有することが明らかになった。
さらに、解析したミクログリアの分泌性プロテアーゼの内、カテプシンS(リソソーム内でタンパク質分解に関与する酵素のリソソーム性プロテアーゼの1種で、分泌されて細胞外マトリクス分解にも関与)の発現のみがミクログリア分子時計により調節されていることも判明したのである。すなわち、カテプシンSの発現量は夜間に最大となり、昼間に最低となることがわかったというわけだ。
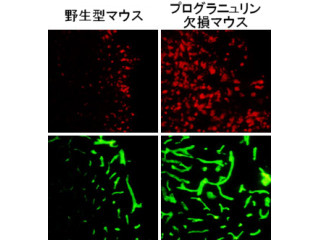
また、カテプシンS欠損マウスでは昼間のシナプス活動性が増大することで日内リズムは消失していることも確認。さらに、カテプシンSを3時間以上適用すると野生型マウスより作成したスライス標本下における皮質ニューロンのシナプス活動性は有意に低下すことが確かめられたのである。
さらに、カテプシンS欠損マウスは野生型マウスと比較して昼間(休止期)の睡眠が浅く、運動量も多く、個体レベルにおいてもカテプシンSの欠損により日内リズムが障害されていることが解明された。これらの結果から、ミクログリア分子時計で制御される脳内のミクログリア特異的分子であるP2Y12受容体ならびにカテプシンSにより、以下のようなメカニズムでシナプス活動性の日内変化が形成されることが示唆されたのである。
夜間、ミクログリアはP2Y12受容体を介してATP濃度勾配に従って活動性の高いシナプス部に向けて突起を伸展し、突起から発現の増大したカテプシンSを分泌すると考えられるという。分泌されたカテプシンSは細胞外マトリクス分解により活動性の高いスパインを退縮させ、昼間に向けてシナプス活動性を低下させると考察している(画像)。このように、ミクログリアはシナプス活動の日内変化の形成に関与することが示唆され、ミクログリアは正常な脳機能を維持する上で不可欠な役割を担っていることが明らかとなった。
下の画像は、ミクログリア分子時計で支配されるP2Y12受容体ならびにカテプシンS発現のシナプス密度ならびにシナプス活動性の日内変化への関与の模式図。昼間(1)ならびに夜間(2)のC57BL/6マウス大脳皮質におけるIba1染色画像を3Dスタックイメージの骨格化画像。細胞内蛍光標識した大脳皮質ニューロンのスパイン(3)ならびにシナプス活動(mEPSC:微小興奮性シナプス後電流)(4)。
研究チームは今後、ミクログリア分子時計の変調が痛覚伝達の亢進ならびに疼痛の慢性化に関与する可能性について検討する予定だ。また、ミクログリアが神経炎症とは一線を画した機序で精神神経疾患の発症に関与することも考えられ、薬剤開発のターゲットになる可能性も考えられるとしている。