東京都医学総合研究所(東京都医学研)は9月11日、奥羽大学、山形大学、金沢医科大学、理化学研究所(理研)との共同研究により、血栓形成の際に起こる現象の「血餅(けっぺい)退縮」が、血栓の主要成分である「フィブリン」が血小板膜上の微小領域である「脂質ラフト」に結合することにより効率よく起こっていることを発見し、同時にフィブリンが脂質ラフトに結合し血餅退縮を引き起こすためには、「血液凝固第XIII因子」が必要であることを遺伝子ノックアウトマウスを使ってつきとめたと発表した。
成果は、東京都医学研 細胞膜研究室の笠原浩二 副研究室長、奥羽大の山本正雅 准教授、山形大の一瀬白帝 教授、金沢医科大の岡崎俊朗 教授、理研の小林俊秀 主任研究員らの共同研究チームによるもの。研究の詳細な内容は、米国東部時間9月3日付けで米科学雑誌「Blood」オンライン版に掲載された。
心筋梗塞や脳梗塞など、血栓性疾患は東京都民の最大の死亡原因の1つだ。そのため、血栓形成の基礎研究は新たな治療戦略に道筋をつける上で重要となる。血管内で血液凝固反応が開始されると血小板は凝集し、「フィブリン網」(フィブリン分子が非共有結合により規則的に重合し不溶性の網として析出したもの)と共に血栓を形成していく。
また血小板は血栓の主要な細胞成分であり、その表面が血液凝固因子の活性化の場となることから、血栓形成開始時において先導的な役割を果たしている。最近、細胞膜は均等に分布しているのではなく、偏った脂質成分が集合した微小領域が存在し、さまざまな生命活動を調節していることがわかってきた。
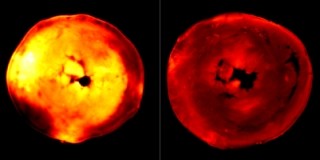
そして血餅退縮とは、血液凝固反応により形成されるフィブリンに捕捉された血球細胞の集塊である血餅が、血小板の働きにより収縮し血管の切断端を引き寄せる止血血栓形成時に起こす現象だ。フィブリン線維が血小板表面上の受容体「インテグリン」に結合し、その内側に「アクトミオシン」が連結し、筋肉のように収縮することによって起こると考えられている。
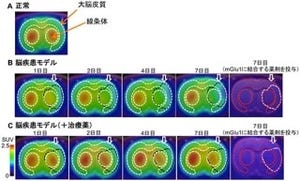
研究チームは、フィブリン線維とアクトミオシンの連結が血小板膜上で一様に起こるのではなく、血小板膜脂質の「スフィンゴミエリン」とコレステロールが集合した脂質ラフトと呼ばれる微小領域で起こることにより収縮に必要な細胞内シグナルの伝達を可能にし、効率よく血餅退縮を起こしていることを明らかにした。
ちなみに脂質ラフトとは、スフィンゴ糖脂質、スフィンゴミエリン、コレステロールに富む細胞膜上に存在すると考えられている微小領域である。さまざまなシグナル伝達分子を結合させることにより、細胞膜を介するシグナル伝達の中継点として働き、多くの生命現象を調節する役目を担う。液体である細胞膜脂質二重層に浮かぶいかだ(ラフト)になぞらえて命名された。
さらに、フィブリンが脂質ラフトに結合し血餅退縮を起こすためには、血液凝固第XIII因子が必要であることも判明。血液凝固第XIII因子は血漿(けっしょう)、血小板、マクロファージなどに存在しており、「トロンビン」の限定分解を受けて活性化される「トランスグルタミナーゼ」だ。フィブリン、「α2プラスミンインヒビター」などの各種タンパク質を分子架橋させることから、「フィブリン安定化因子」とも呼ばれており、今回の研究によりその新しい機能が示された。
今回の研究から、血小板膜上の微小領域である脂質ラフトによる血餅退縮促進の仕組みが明らかになった。従って、ラフトを構成する脂質や血液凝固第XIII因子を標的とした、血栓性疾患における新たな検査法や治療法の開発につながることが期待されるとしている。