京都大学は9月6日、理化学研究所(理研)、東京大学、大阪大学(阪大)、オーストラリア・クイーンズランド大学との共同研究により、マウスの性が決定する仕組みに関する新たな知見を発見したと発表した。
成果は、京大 ウイルス研究所の立花誠准教授、同・黒木俊介教務補佐員、理研 眞貝細胞記憶研究室の眞貝洋一 主任研究員、同・バイオリソースセンター 遺伝工学基盤技術室の小倉淳郎 室長、同・疾患ゲノム動態解析技術開発チームの阿部訓也 チームリーダー、東大大学院 農学生命科学研究科の金井克晃 准教授、阪大 微生物病研究所の野崎正美准教授、クイーンズランド大のPeter Koopman教授らの国際共同研究チームによるもの。研究の詳細な内容は、9月6日付けで米科学誌「Science」に掲載された。
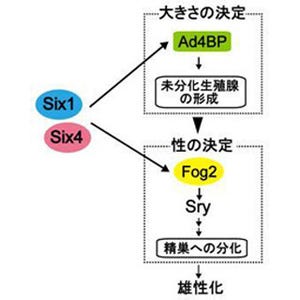
雌雄の性へ分化することは、動物にとって子孫を次世代へつなぐためにとても重要な細胞の分化過程だ。われわれ人間を含めた多くのほ乳類では、性染色体の型がXYだと雄になり、XXだと雌になる。具体的には、ヒトの場合はY染色体上の遺伝子「SRY(Sex-determining region Y)」が、マウスの場合は遺伝子「Sry」が胎児期に一過性に発現すると雄になる仕組みだ(画像1)。一方、XX胎児ではSRY遺伝子が発現しないため、雌へと分化するのである。
しかし、どのような仕組みでSRYやSryが発現するのか、これまで大きな謎だった。Sryの場合、その発現はまだ雌雄に分化していない胎児期の生殖腺で起きる。この発現が個体を雄へ誘導することがわかっているが、どのようにしてSryが胎児期の生殖腺で決まった時期に発現するのか、その仕組みはほとんどわかっていなかった。
DNAは「ヒストン」というタンパク質に巻きついて細胞の核内に存在する。ヒストンはさまざまな酵素によって化学修飾されるが、それらの修飾は多くの生命機能に重要な役割を果たしている。今回の研究では、まずそのヒストンの脱メチル化酵素「Jmjd1a」を遺伝学的に破壊した「Jmjd1a-KOマウス」が作成された。
すると、性染色体がXYであるにも関わらず、雄から雌への性転換が起きることが確認されたのである。Jmjd1a-KOマウス胎児を詳細に調べた結果、性決定遺伝子、Sryの発現が低下していることが確認された。Jmjd1aはSry遺伝子が巻きついたヒストンから、発現に抑制的に働くヒストン修飾であるヒストン「H3」の9番目の「リジン」(H3K9)のメチル化を外すことによって、Sry遺伝子を活性化することが明らかになったのである(画像2)。
具体的には、Jmjd1aによってSry遺伝子が巻きついたヒストンのメチル化修飾が外されると、Sry遺伝子の発現率が上昇。しかし、Jmjd1aが欠損したマウスではSry遺伝子の発現が十分でなくなるため、雌化してしまうというわけだ。H3K9がメチル化されると、そこに巻きついた遺伝子の発現が抑えられるのである。
今回の研究により、ヒストンの化学修飾が性決定遺伝子であるSryの発現を直接制御していることが示された形だ。この成果から、正しく性決定遺伝子が活性化されなかった場合には、たとえ性染色体がXYであっても、雌になるケースがあるといえるという。
人間において性分化が正しく進行しなかった疾患を性分化疾患と呼ぶ。性分化疾患の内で、その原因がわかっていない症例はおよそ半分を占める。今回の研究は、胎児期にヒストン修飾が正しく行われなかったことが、性分化疾患の新たな原因の1つである可能性を示すものだ。今後、Sry遺伝子のみならず、そのほかのほ乳類の性分化過程に関わる遺伝子について、その発現制御機構とヒストン修飾との関連を調べていきたいとしている。