理化学研究所(理研)は8月1日、神経回路が完成した成熟後のマウスの小脳で、神経細胞の1種である「プルキンエ細胞」の「イノシトール三リン酸(IP3)受容体」が、「樹状突起」上にある「スパイン」の数を制御し、正常な神経回路を維持していることを明らかにしたと発表した。
成果は、理研 脳科学総合研究センター 発生神経生物研究チームの御子柴克彦チームリーダー、同・菅原健之研究員、同・久恒智博研究員、同・運動学習制御研究チームの研究者らの共同研究チームによるもの。研究の詳細な内容は、7月24日付けで米科学誌「The Journal of Neuroscience」に掲載された。
ヒトの脳では、数1000億個の神経細胞がシナプスを介して結合し、神経回路を形成している。シナプスは、神経細胞の樹状突起上にある無数のスパインと呼ばれる小さな突起に形成される(画像1)。スパインは、シナプス前部である神経軸索終末とシナプスを形成する後部構造であり、神経伝達物質を受け取る受容体やシグナル伝達物質が多く存在するため、脳機能に不可欠な構造だ。
このスパインは生後の発達に伴って形成され、神経回路が完成した成熟後は安定な構造になり、発達期にできた神経回路は維持される仕組みだ。その一方で、一部のスパインは成熟後も学習や記憶、環境などにより再編成される。スパインにはグルタミン酸などの神経伝達物質に対する受容体が存在し、ほかの神経細胞から情報を受け取る部位であることから、高次脳機能に極めて重要な構造だ。
また、統合失調症や自閉症などのさまざまな神経疾患においてスパインの形や数に異常が見られることから、神経疾患とスパインの形成を制御するメカニズムとの関連が注目されている。そのため、神経細胞のスパインが成熟後の脳でどのように制御されるのかを知ることは、脳のメカニズムや神経疾患の病態の解明において重要な課題となっているが、ほとんどが未解明のままだった。
神経細胞はシナプスから入力を受けると、まず細胞内のカルシウム濃度が変化する。カルシウムは細胞内の情報伝達物質として非常に重要な働きをするため、カルシウム濃度を適切に調節することが求められ、その濃度調節に重要な役割を果たしている分子の1つがIP3受容体だ。
IP3受容体は、細胞内のカルシウム貯蔵庫の1つである「小胞体」の膜上にあるイオンチャネル(イオンが通過する小孔)で、細胞外の刺激に応じて貯蔵庫からカルシウムを放出する。IP3受容体には3種類のタイプがあり、タイプ1のIP3受容体(IP3R1)は脳の神経細胞に広く存在し、特に小脳のプルキンエ細胞(小脳皮質に一層に並ぶ神経細胞のことで、小脳の中で唯一の出力細胞)に豊富に発現している。
研究チームはこれまでに、全身でIP3R1を機能不全にした「IP3R1ノックアウトマウス」が、運動が円滑に遂行できなくなる小脳失調やけいれん様発作を起こすこと、また記憶や学習の基礎とされる「神経可塑性」(シナプス入力の強さや頻度に応じて、神経細胞間の情報伝達の効率が柔軟に変化するこ)の異常を示すことを明らかにしてきた。
しかし、IP3R1が脳神経系に広く発現していること、また、IP3R1ノックアウトマウスが生後20日前後の未成熟なうちに死亡してしまうため、成熟後の脳でプルキンエ細胞のIP3R1がどのような役割を果たしているのか、その解明に至っていなかったのである。
そこで研究チームは、成熟後の脳でプルキンエ細胞のIP3R1が果たす役割を明らかにするために、プルキンエ細胞だけでIP3R1を欠損させた遺伝子改変マウス(プルキンエ細胞特異的IP3R1欠損マウス)を作成。そして、このマウスの歩行機能が調べられた結果、6週齢から小脳失調症状に見られる「ふらつく」などの歩行障害を示すことが確認された。さらにこの症状は、週齢が進むに従って強くなり、正常な姿勢を保っていられないほど重症化したのである(画像2)。
また、プルキンエ細胞特異的IP3R1欠損マウスのプルキンエ細胞でのIP3R1の発現を週齢を追った解析も行われ、その結果、小脳失調症状が現れる6週齢になると、ほとんどのプルキンエ細胞でその発現がなくなることが判明した(画像3)。これらの結果から、プルキンエ細胞のIP3R1の発現が消失する時期と小脳失調の発症時期が一致することが明らかになったのである。
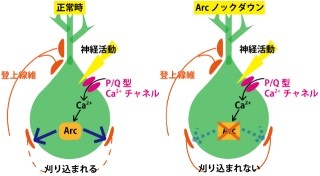
次に研究チームは、小脳失調を示す変異マウスでは、しばしば小脳の萎縮や神経細胞の脱落が観察されることから、プルキンエ細胞特異的IP3R1欠損マウスの小脳の形態について検討。その結果、小脳の萎縮やプルキンエ細胞の脱落は観察されなかった。しかしプルキンエ細胞の形態が詳細に解析されると、樹状突起とスパインの形態に異常が観察されたのである。プルキンエ細胞が、正常マウスと比べて樹状突起の分岐が少なく隙間が多いことがわかったのだ(画像4)。
さらに、正常マウスの樹状突起にはある程度の間隔を空けてスパインが形成されているのに対し、隙間がほとんどないほどにスパインの数が異常に増加し、形も長くなっていた。このスパインの異常は、小脳の神経回路がほぼでき上がる時期である3週齢では観察されず、10週齢でスパインの数が異常に増加する。つまり、成熟してから生じたものであることがわかった(画像5)。また、その形も異常に長くなっていた。つまり、プルキンエ細胞特異的IP3R1欠損マウスでは、正しいスパイン密度および形態を維持するメカニズムが破綻しているというわけだ。
さらに、研究チームがこの異常に増加したスパインがシナプスを形成しているのかを調べらたところ、これらは小脳皮質に存在する顆粒細胞の神経軸索である平行線維とシナプスを形成し、機能していることが判明(画像6・7)。これらの結果は、プルキンエ細胞特異的IP3R1欠損マウスの小脳では、発達の過程で一度正常にプルキンエ細胞のスパインが形成されて正しく神経回路ができ上がったにも関わらず、成熟後に正常な神経回路を維持するメカニズムが破綻したということを意味しているという。これにより、IP3R1がプルキンエ細胞のスパインの数を制御することが、小脳の正常な神経回路を維持するのに重要であることが明らかになった。
続けて研究チームは、小脳の機能の1つである運動学習についても調査を行った。その結果、プルキンエ細胞特異的IP3R1欠損マウスでは、記憶や学習に必要な神経可塑性が失われていることが発見されたのである。また、小脳が担う運動学習の1つである「眼球運動の適応」も解析され、正常マウスでは、1時間の学習で眼球運動の適応が起こったのに対し、プルキンエ細胞特異的IP3R1欠損マウスでは適応が起こらず、運動の学習ができないことがわ確かめられた(画像8・9)。IP3R1が運動学習に必須な分子であることを生体が明らかになったのである。
|
|
|
|
眼球運動の適応についての解析結果。画像8(左):眼球運動の適応とは、外界の景色(この実験ではチェックパターンのスクリーン)の動きに対して、その動きについていけるように目の動きを補正する現象。正常マウスでは1時間の学習により、スクリーンの動きとのずれが小さくなるよう、目の動きが大きくなる。 |
|
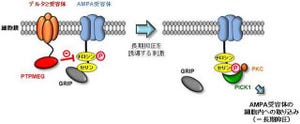
以上の結果から、成熟後の小脳において、IP3R1がプルキンエ細胞のスパインの数を制御することで機能的な神経回路を維持し、このメカニズムが小脳の機能である運動のコントロールや学習に中心的な役割を果たしていることが示された(画像10)。
研究チームは今後、IP3R1を介した貯蔵庫からのカルシウム放出がどのようにして神経回路を制御しているのか、その詳細なメカニズムの解明を進めていく予定だ。また、統合失調症や自閉症など多くの神経疾患と神経細胞のスパイン形態異常の関連が注目されていることから、これら神経疾患の病態解明に今回の研究の成果が貢献することが期待できるという。特に、日本で特定疾患に指定されている難病である「脊髄小脳変性症」の原因遺伝子として、IP3R1が同定された点が大きい。今回の研究の成果は、発症メカニズムが不明であり、有効な治療法がなかった脊髄小脳変性症の病態を理解する上でも重要な発見であり、治療法の確立につながる可能性を秘めているとしている。