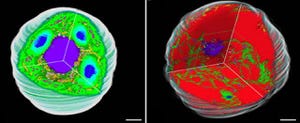
科学技術振興機構(JST)と理化学研究所(理研)は7月16日、代謝経路を制御することで光合成微生物のラン藻が作る「バイオプラスチック」の増産に成功したと共同で発表した(画像1)。
成果は、小山内崇 JSTさきがけ研究者の(理研 環境資源科学研究センター 客員研究員)、理研の平井優美チームリーダー、同・斉藤和季グループディレクター、同・沼田圭司チームリーダー、同・及川彰客員研究員らの研究チームによるもの。研究はJST 課題達成型基礎研究の一環として行われたもので、詳細な内容は、7月16日付けで科学誌「DNA Research」に掲載された。
プラスチックは現代の社会生活に必要不可欠な素材だが、石油を原料とすることから、将来的な資源の枯渇の問題や価格高騰による経済的負担、自然界で分解されないことによる環境負荷の増大につながるなど多くの課題を抱えている。
そこで現在、世界中で精力的に開発が進められているのが、再生可能な生物資源から生産されるバイオプラスチックだ(環境中の微生物によって分解が可能な「生分解性プラスチック」も含めた総称としてバイオプラスチックという表現もされる)。
すでに製品化はされているが、従来のプラスチックに比べてコスト高であることから普及が進んでいない。例えば、代表的なバイオプラスチックである「ポリヒドロキシアルカン酸(PHA)」は、工業規模の生産も行われているが、糖や油脂を原料としており、生産コストの面に加えて、エネルギー供給や資源の枯渇、糖類の価格変動など沢山の問題を抱えており、従来のプラスチックと変わらない。
そこで、小山内研究者らは、酸素発生型光合成を行う原核生物である「シアノバクテリア(ラン藻)」が、窒素やリンの欠乏時にPHAの1種である「ポリヒドロキシ酪酸(PHB)」を合成する「光合成微生物」であることに着目。ラン藻は、大気中の二酸化炭素を直接体内に取り込み、光合成反応により、光を直接エネルギー源として利用することができるため、理想的なPHB生産方法となる可能性を持っているのだ。
ところが、その収量は現在生産に利用されている微生物に比べて1桁以上低いという問題を有していた。これまでの研究でラン藻PHBの生合成経路は明らかになっているものの、増産のカギとなるPHB合成遺伝子の転写制御機構については未解明の部分が多く、その解明が望まれていたのである。
今回の研究では、ラン藻種の中で最も広く研究されている「Synechocystis sp. PCC6803(シネコシスティス)」の「SigEタンパク質」が着目された。SigEは、「RNAポリメラーゼシグマ因子」(転写を担うタンパク質で、DNAと直接結合して遺伝子の転写を選択的に開始する役割を担う)の1つで、特に炭素の貯蔵源である「グリコーゲン」の分解に関与する遺伝子を制御することから、炭素代謝のグローバルな制御因子であることが知られている。小山内研究者の過去の大規模転写解析より、SigEによるPHB生合成遺伝子の転写制御の可能性が示唆されていたため、SigE過剰発現株(SigEタンパク質量が増加した株)を作製し、PHB生合成への影響が調べられた。
その結果、SigE過剰発現では、炭素貯蔵源であるグリコーゲンを分解する酵素が増加すると共に、PHB合成酵素の転写量やタンパク質量が増加することが判明。実際に、細胞を窒素欠乏状態(画像1の試験管の黄色い培養液が窒素欠乏になった状態)にした上でPHB生産量が調べられたところ、SigE過剰発現によって、PHB量が約2.5倍に増加したことがわかった(画像2)。PHBの分子量やモノマーの種類は、SigEタンパク質の増加には影響を受けないことも同時に明らかになったのである。なお、PHBは窒素欠乏時に細胞内に蓄積される仕組みだ。
|
|
|
画像2。窒素欠乏後の細胞バイオマスと、3mM(ミリモーラー)の塩化アンモニウムで9日間培養して窒素源を使い切らせた後のPHB量。SigEタンパク質の増やしたことにより、PHB量が約2.5倍増加している |
SigEの改変によって、炭素代謝自体が大きく変動していることが予測されたため、「メタボローム解析」(細胞内の代謝産物(メタボライト)を一斉に測定する解析手法)が行われた。すると、「グルコース-6-リン酸」などの「糖リン酸」、「GDP-マンノース」などの「糖ヌクレオチド」、クエン酸などの炭素化合物量が変化することが確認された。
特に、窒素欠乏1日後のクエン酸量を比較すると、SigE過剰発現株では、野生株の4倍近い量になることがわかった。クエン酸は、「アセチルCoA」と「オキサロ酢酸」から合成する反応から始まる一連の代謝経路である「TCAサイクル」(呼吸に用いられる還元力を生産すると共に、二酸化炭素が生成される)の代謝産物であり、アセチルCoAから合成される点はPHBと同じため、PHB生産と競合することが予想される。今後は、このような副次経路への代謝の流れを減少させることにより、さらなるPHB増産が期待できるという。
ラン藻のPHB合成酵素遺伝子の転写制御因子は、これまでに機能解析が詳細に行われておらず、SigEは、PHB量の増加に直接寄与することが明らかになった初めての転写制御因子だ。また、グリコーゲンからPHBという代謝経路が、SigEという1つの転写制御因子によって統合的に制御されていることが今回は明らかになった(画像3)。これは、従来のような局所的な代謝活性の改変ではなく、SigEを過剰発現させ、炭素代謝全体を制御するという方法でグリコーゲンからバイオプラスチックまでの炭素代謝を統合的に改変し、PHBの増産ができたことを意味するという。
画像3はSigE転写制御因子(タンパク質)の増加によるプラスチック生産のモデルだ。SigE転写制御因子が増加すると、細胞内の炭素貯蔵源であるグリコーゲンの分解が促進し、「酸化的ペントースリン酸」経路という単糖類を分解する経路の酵素群が増加。さらに、PHBを合成する酵素が増加し、PHB生産が促進されるという流れだ。このように、SigEのタンパク質が増加することで、一連の炭素代謝のさまざまな酵素量が変化し、バイオプラスチック量が増加することが明らかになったのである。
今回の成果により、PHB生合成遺伝子の転写制御機構の解明が、PHB生産の高収率化につながることが明らかになった形だ。ただしPHB量は約2.5倍の増加が見られたが、乾燥細胞重量当たりのPHB量では2%程度であり、今後さらなる増産が必要だという。また、PHBの量だけでなく合わせてPHBの質の向上や、抽出などの工程のコスト減を段階的に達成することも課題だとした。
また今回の実験系では、二酸化炭素ガスを炭素源としているため、今後ラン藻を用いたバイオプラスチック生産系を発展させ、PHBの収量をさらに向上させることで、光と二酸化炭素を利用したバイオプラスチック生産の技術基盤を構築し、カーボンニュートラルな物質生産系の構築につながることが期待されるとも小山内研究者らは述べている。
さらに、今回の研究成果は転写制御因子を用いて炭素代謝を広く改変することができた事例であることから、転写制御因子を用いることで、従来のように代謝酵素のレベルではなく代謝経路のレベルで制御できることを明らかにし、新たな代謝工学手法による物質生産の有効性を示したものだという。近い将来にはこの新手法が広がり、微細藻類の代謝を改変し、光と二酸化炭素を利用した物質生産の基盤となることが期待されるとしている。