横浜市立大学(横浜市大)は、世界で初めてヒトiPS細胞から血管構造を持つ機能的なヒト臓器を創り出すことに成功したと発表した。
同成果は同大大学院医学研究科 臓器再生医学の谷口英樹 教授、武部貴則 助手らによるもの。詳細は英国科学誌「Nature」に掲載された。
臓器の機能が損なわれてしまう病気「末期臓器不全症」に対して、機能を損なった臓器を健常な臓器へ置換する臓器移植が有効な治療法として実施されているが、ドナー臓器の供給は絶対的に不足しており、臓器移植に代わる新たな治療法の確立が求められている。そうした状況から、iPSやES細胞などの多機能性幹細胞を用いて、分化誘導した臓器の細胞を活用して、臓器の機能を回復させるといった再生医療研究が世界各所で進められているが、臓器を構成するためにはさまざまな種類の細胞が必要となるため、これまで立体的な構造を持つ「臓器」の創出に成功したという報告はされてこなかった。
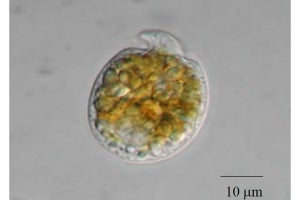
今回研究グループは、臓器の創出を果たすために臓器の原器(Organ bud)を誘導することを第一目標とし、研究を行った。これまでの研究から、発生初期段階の肝臓原基は、単純なシート構造の内胚葉細胞(Hepatic endoderm)の集団より形成されることが知られており、これらが血液の流入より先の任意のタイミングで、隣接する血管や間葉系の細胞と混ざり合いながら、3次元的な組織構造を持つ原基(臓器の種)を形成することが報告されていたことから、この発生初期段階で3次元組織が形成される過程を模倣し、血管や間葉系細胞との相互作用を人為的に再現することで、試験管内においても内胚葉細胞から立体的な肝臓の原基を誘導出来るという仮説を立て、検証を行ったという。
その結果、特別な条件下で未分化な3種類の細胞(内胚葉細胞、血管内皮細胞、間葉系細胞)を共培養することで、培養48時間程度で立体的な肝臓の原基(肝芽:Liver Bud)が自律的に形成されることを確認したという。
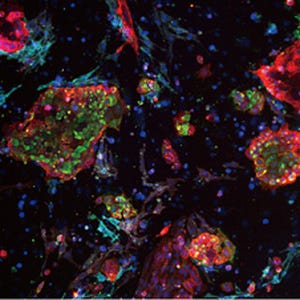
さらに、このヒトiPS細胞より誘導した肝芽を免疫不全マウスに移植したところ、48時間の早期段階で血流を持つヒト血管網を再構成し、最終的にたんぱく質の合成や薬物の代謝などヒトの肝臓に特徴的な機能を持つ組織へと成熟することも確認されたとする。
加えて、ヒトiPS細胞由来肝芽が移植により肝臓の総合的な機能を代替することが可能か否かを検証する目的で、薬剤により肝不全を発症する免疫不全マウスへの移植実験を実施したところ、非移植群のマウスと比較して、ヒトiPS細胞由来肝芽移植群は有意に生存率が改善したことが確認されたことから、生体内で分化誘導されたヒト肝細胞が肝臓の総合的な機能を発揮し、治療効果が発現していることが示されたとしている。
今回の成果について研究グループは、臓器不全症を対象にした新たな治療概念「臓器原基移植療法(Organ bud transplantation therapy)」を提唱できるものであり、今後、3次元臓器原基の大量製造技術や、最適な移植手法などを検討することで、肝疾患患者を対象としたiPS細胞を用いた再生医療実現化や内胚葉に由来する肝臓以外の臓器(膵臓など)への応用の可能性の検討へ向けた研究開発を加速していく方針と説明している。また、新たな医薬品を開発する創薬産業への細胞供給を行う上での重要な技術になる可能性があるとしており、日本で機能的なヒト肝細胞/肝組織を製造できれば、日本の医薬品開発の国際競争力の向上につながることが期待され、将来的には、それらを海外市場に輸出したり、海外からの薬剤評価の受託試験の実施などによる、新たな市場開拓も期待できるとしている。