沖縄科学技術大学院大学(OIST)は5月29日、「視細胞」の変性とその細胞内で起こるタンパク質の輸送異常を結び付けるメカニズムを明らかにしたと発表した。
成果は、OIST 神経発生ユニットの政井一郎准教授、同・西脇優子研究員(論文・主執筆者)らの研究チームによるもの。研究の詳細な内容は、5月28日付けで「Development Cell」に掲載された。
細胞の健康の維持には、細胞内でタンパク質の輸送を担う「小胞」が機能する必要がある。小胞は小さな泡のような構造をしており、細胞内のさまざまな膜から出芽したり融合したりしながら、内部に取り込んだタンパク質を輸送している。
小胞が細胞内で膜に融合するプロセスは、「SNARE複合体」という一群のタンパク質によって制御されている。小胞の膜表面にある1つのSNAREタンパク質が、ターゲットとなる膜上にある別の3種のSNAREタンパク質と出会うと、融合プロセスが始まるという仕組みだ。その後に別の2種のタンパク質「β-SNAP」と「NSF」が、融合で生じたSNARE複合体を解離させ、次回の膜融合に備えるのである。
この輸送システムが種々の異常によって機能を停止すると、細胞は「アポトーシス(プログラム細胞死)」を起こしてしまう。眼の視細胞のアポトーシスは、失明に至る「網膜色素変性症」と関連している。これまでの研究で、タンパク質の輸送異常と視細胞アポトーシスの関連が報告されていたが、その背景にあるメカニズムは解明されていなかった。
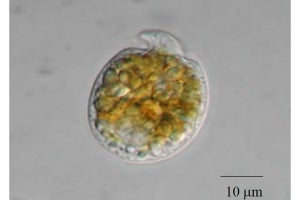
研究チームは今回、β-SNAPが機能しないゼブラフィッシュ(画像1)をモデル動物として使い、SNARE複合体が解離されない状況では、ターゲット側の膜上にあるSNAREタンパク質の1つである「BNip1」が、視細胞のアポトーシスを起動することを発見。
一方、β-SNAPが正常に機能する場合には、BNip1による細胞死のプログラムの起動は阻止される。このように、BNip1はSNARE複合体の一員であると同時に、視細胞のアポトーシスを起動するという2つの役割を担うことで、膜融合とアポトーシスという2つのプロセスを結び付けていることが判明した。
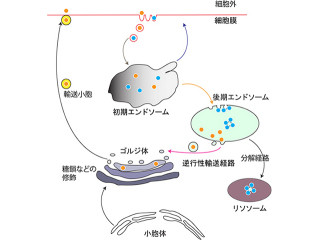
より正確に説明すると、BNip1は「syntaxin18 SNARE複合体」の1つのとして、輸送小胞とターゲット膜との融合に働く。β-SNAPの機能低下によりSNARE複合体の解離が阻害されると、BNip1を介して視細胞にアポトーシスが誘導される。β-SNAPによるSNARE複合体の解離は、小胞融合に必須なステップなので、BNip1は小胞融合の異常を感知して細胞死を起こす「緊急停止ボタン」として機能するというわけだ(画像2)。
なお、研究グループの1人である西脇研究員は、「BNip1は、視細胞内の大きな赤い停止ボタンに例えることができます。今回、視細胞変性の原因となる新たな仕組みを突き止めたことで、網膜色素変性症をはじめとするさまざまな失明疾患や視覚障害の治療につながると期待しています」とコメントしている。