岡山大学は5月24日、難治性脳腫瘍の「悪性グリオーマ」に対する新規分子標的薬(現在開発段階)である、「シレンジタイド」の抗腫瘍効果メカニズムを遺伝子レベルで解明したと発表した。
成果は、岡山大 病院脳神経外科の黒住和彦講師らの研究チームによるもの。研究の詳細な内容は、4月15日付けで「SpringerPlus」に掲載された。
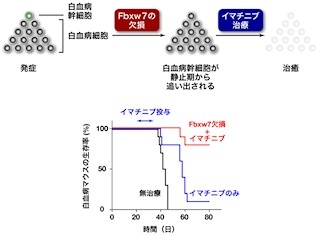
「脳のがん」ともいわれる悪性グリオーマは、増殖スピードが速い、血管新生が起こる、正常脳に浸潤しやすいことなどの特徴がある。近年、悪性グリオーマの治療薬として、さまざまな新規分子標的薬が開発されて臨床試験段階に進んでおり、シレンジタイドもその中の1つだ。同薬は、殺細胞効果、抗血管新生効果、抗浸潤効果、ほかの治療との併用効果など多様な効果があり、現在、世界規模の臨床試験が行われているところである。
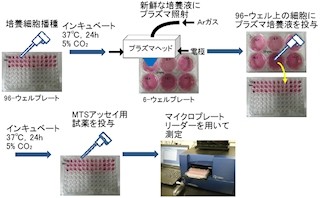
細胞接着因子「インテグリン」は、がんの増殖、血管新生や浸潤に関係するといわれている。シレンジタイドはこのインテグリン分子に対する分子標的薬だ。今回、悪性グリオーマ細胞をシレンジタイドで処理したところ、グリオーマ細胞における殺細胞効果が認められた。
さらに、そのシレンジタイドで処理した悪性グリオーマ細胞を使って「DNAマイクロアレイ解析」が行われたところ、アポトーシスに関連する遺伝子群の発現が変化していることが判明したのである。中でも、アポトーシス関連遺伝子の「カスペース8」の変化がわかり、細胞実験、動物実験においても、このカスペース8遺伝子の発現の変化が確認されたというわけだ。
今後、変化のある遺伝子に注目して薬剤の開発を進めていけば、さらに効果的な治療法、治療薬を生み出すことができるものと期待されるとしている。