北海道大学(北大)は5月15日、産業技術総合研究所(産総研)との共同研究により、安定な構造を取るウイルス由来の1本鎖RNA(リボ核酸)が、RNA検知システムとしての機能を持つ微生物認識受容体の1種「TLR(Toll-like receptor)3」によって認識されることを明らかにし、さらにTLR3の新しい「リガンド」(受容体を含むタンパク質やそのほかの生体分子に特異的に結合する物質)も同定したと発表した。
成果は、北大大学院 医学研究科免疫学分野 学生の立松恵氏、同・瀬谷司教授、同・松本美佐子特任准教授、産総研の西川富美子氏らの研究チームによるもの。研究の詳細な内容は、日本時間5月15日付けで英国科学誌「Nature Communications」に掲載された。
DNAを設計図として各種タンパク質が作られていくことで、ヒトを含む多くの生物が生命として活動できるわけだが、DNAからタンパク質合成への中継ぎ役というのがRNAの主立った役割だ。DNAの陰に隠れた存在のように思えるかも知れないが、近年、RNAにはさまざまなタイプが存在しており、生命現象を制御している重要な存在であることがわかってきた。
通常RNAはDNAとは異なり1本鎖の構造を取っているが、ウイルスの複製過程では2本鎖RNAが生じる。2本鎖RNAは宿主には存在しないため、強力に宿主の免疫系を活性化するという能力を持つ。そうしたことから、近年になって、免疫系を活性化するための創薬としてRNAが注目されており、TLR3リガンドはがんや感染症の次世代ワクチン「アジュバント」(免疫賦活化物質)として開発が期待されている。
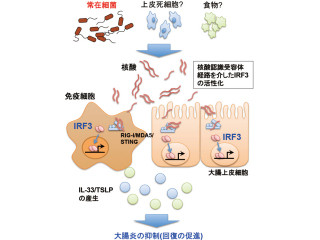
そのTLR3は、細胞外のウイルスRNA検知システムと考えられている。ウイルス複製時に生じる2本鎖RNA(double-strand(stranded) RNA:dsRNA)は細胞外に放出されると、「dsRNA取り込み受容体」を介して細胞内に取り込まれ、「エンドソーム」(細胞内小器官の1種で、細胞内に存在する細胞外物質を取り込む小胞)に存在するTLR3で認識され、免疫系の「タイプIインターフェロン(IFN-α/β)」や「サイトカイン」産生などの抗ウイルス応答が誘導される仕組みだ。
ちなみにインターフェロンとは、動物の体内に侵入してきた病原体や発生した腫瘍細胞などの異物に反応して細胞から分泌されるタンパク質のことだ。サイトカインはさまざまな細胞から分泌され、細胞同士の情報伝達に関わり、特定の細胞の働きに作用するなど、多様な生理活性を持つタンパク質のことである。
一方これまでに、dsRNAを生じにくいウイルス感染や非感染性の「ネクローシス細胞」(外傷などにより予期せず死んでしまった細胞のことをいい、細胞が膨張し破裂や溶解が起き、細胞内容物が周囲に拡散することで炎症が引き起こされる)による炎症応答にTLR3が関与することが報告されていたが、TLR3が実際にどのようにRNAを認識するのか、そのこと自体はよくわかっていなかった。そこで研究チームは今回、TLR3が認識するRNA構造を同定することに挑んだのである。
具体的には、ポリオウイルス(PV)の遺伝子配列を基に、種々の長さの2本鎖および1本鎖RNA(single strand RNA:ssRNA)を試験管内で合成し、TLR3を介してインターフェロンやサイトカイン産生を誘導するのか、ヒトおよびマウス細胞を用いて検討が行われた。
さらにTLR3との結合能、RNAの細胞内取り込み、エンドソームにおけるTLR3との会合を、共焦点レーザー顕微鏡などを用いて解析が試みられたのである。RNAの2次構造予測については、3種類の構造予測ソフトを用いたコンピュータ解析が行われ、実際のマッピング実験から最も適した2次構造が決定された。
TLR3についてまず判明したのは、dsRNA以外にもいくつかのPV由来の1本鎖RNA「PV-RNA」を認識するということだ。このRNAは、RNA分解酵素に抵抗性の安定な構造を取っており、結合組織を構成する「ヒト線維芽細胞」や体表面(つまり皮膚)の「上皮細胞」、白血球の1種の「マウスマクロファージ」や免疫細胞の1種の「樹状細胞」からTLR3を介してタイプIインターフェロンやサイトカイン産生を誘導することが確認された。
さらにPV-RNAは、dsRNA同様に分子「ラフトリン」に依存した経路でエンドソームに取り込まれ、TLR3と相互作用し活性化する。コンピュータ解析によるRNA2次構造予測とdsRNA領域のマッピング実験から、PV-RNAは不完全なdsRNA領域を有することがわかり、TLR3はこの領域を認識することが推測された。
TLR3は、ウイルスの複製で生じる完全な2本鎖RNAだけでなく不完全なdsRNAを有する安定な構造の1本鎖RNA「structured RNA」も認識することで、多様なウイルス感染に対応するだけでなく、炎症などで細胞外に放出された自己由来のRNAに対しても免疫応答を誘導すると考えられるという。
なお近年になって、ネクローシス細胞やウイルス感染細胞が引き起こす炎症とがん・自己免疫疾患・生活習慣病との関連が注目を浴びており、分子基盤の解明が始まっているところだ。TLR3は樹状細胞やマクロファージなどの抗原提示細胞に発現しており、TLR3からのシグナルは樹状細胞の成熟化を促し、リンパ球の1種の「ナチュラルキラー細胞(NK細胞)」や「細胞傷害性T細胞」の活性化を誘導する仕組みである。さらに線維芽細胞においてTLR3が活性化すると、核のリプログラミングが起きやすくなることも確認済みだ。
今回の研究で、TLR3は多様なRNAを認識することが初めて明らかとなった。ウイルスの持続感染や慢性炎症で誘発されるさまざまな遺伝子発現が、ウイルスや自己由来のRNAをTLR3が認識することで起きる可能性が示唆され、組織再生や炎症応答制御に向けて今後の研究の進展が期待されると、研究チームはコメントしている。