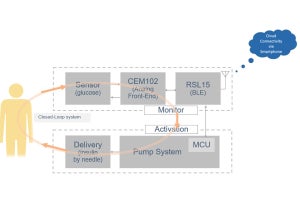
理化学研究所(理研)と慶應義塾大学(慶応大)は5月13日、京都大学との共同研究により、「思春期特発性側彎症(Adolescent Idiopathic Scoliosis:AIS)」の発症に関連する新たな遺伝子「GPR126」を発見したと発表した。
成果は、理研 統合生命医科学研究センター 骨関節疾患研究チーム 池川志郎チームリーダー、同・稲葉(黄)郁代研究員、慶応大 医学部整形外科 脊椎外科研究グループの松本守雄准教授を中心とする側彎症臨床学術研究グループ、京大 再生医科学研究所 生体分子設計学分野の開祐司教授、同・宿南知佐准教授、滝本晶研究員、郭龍研究生らの研究チームによるもの。研究の詳細な内容は、日本時間5月13日付けで英国科学誌「Nature Genetics」に掲載された。
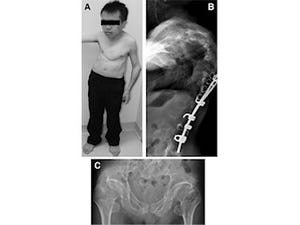
側彎とは、背骨が横に曲がった状態をいい(画像1)、もともとヒトの背骨は完全に真っ直ぐではないが、曲がりの角度が10度以上になると病的(側彎症)と考えられている。それが曲がりの角度が20度を超えると、装具の着用など何らかの治療をする必要が生じ、40度を超えると、多くの場合手術治療が必要だ。さらに重度になった場合は、肺機能が低下し、腰痛や背部痛の発症が増加するとされている。進行すると治療が困難になるので、早期発見が大切だ。
側彎症を引き起こす原因はいくつもあり、神経麻痺や筋ジストロフィーなど、明らかな疾患に続いて起こることもあるが、多くは原因が特定できない「特発性側彎症」だ。特発性側彎症は、発症時期などによりいくつかのタイプに分けられる。その内、最も発症頻度が高いのが、10歳以降に発症・進行する思春期特発性側彎症(AIS)で、全世界で人口の約2%に見られる発症頻度の高い疾患だ。日本では、学校保健法により側彎の学校検診が義務付けられているほど、社会的に医療上重大な問題となっている。
過去の疫学研究などから、AISは遺伝的因子と環境的因子の相互作用により発症する多因子遺伝病であることは明らかになっていた。これまで世界中の研究者たちが「連鎖解析」や「候補遺伝子アプローチによる相関解析」など、さまざまな手法を用いてAISの原因遺伝子の探索を行ってきている。理研でも慶応大と共同研究により、2011年にAIS発症に関連する疾患感受性遺伝子「LBX1」を同定した実績を持つ。
しかし、多因子遺伝病であるAISの原因や病態を解明するためには、さらなる遺伝子の同定が必要だ。そこで、今回の共同研究チームが結成され、新たな患者サンプルとその臨床情報の提供をもとに、LBX1に続く新たなAISの疾患感受性遺伝子の同定に挑んだのである。
理研 骨関節疾患研究チームは、側彎症臨床学術研究グループによる厳格な診断基準のもと、詳細な臨床情報と共に収集された日本人女性のAIS患者1033人と対照者1473人のDNAサンプルを用いて、疾患の感受性遺伝子を見つける方法の1つである「ゲノムワイド相関解析(Genome-Wide Association Study:GWAS)による解析を実施した。
GWASは、ヒトのゲノム全体をカバーする遺伝子多型を用いて、疾患を持つ群と疾患を持たない群とで遺伝子多型の頻度に差があるかどうかを統計学的に比較する解析方法だ。検定の結果得られた、偶然にそのようなことが起こる確率を意味する「P値」が低いほど、相関が高いと判定できる仕組みである。
ヒトのゲノム全体をカバーする約55万個の「一塩基多型(Single Nucleotide Polymorphism:SNP)」が調べられたところ、AISと非常に強い相関を示すSNPが発見された。すでに2011年に報告した10番染色体上の3つのSNP以外にも、6番染色体、4番染色体、X染色体の3カ所に高い相関を示すSNPが存在していたのである。
ヒトゲノムは30億塩基対のDNAからなるとされているが、個々人を比較するとその中で0.1%の塩基配列に違いがあると見られており、これを遺伝子多型といい、その内で1つの塩基がほかの塩基に変わるものをSNPという。遺伝子多型は遺伝的な個人差を知る手がかりとなるが、その多くはSNPというわけだ。そのタイプにより、遺伝子を基に体内で作られる酵素などのタンパク質の働きが微妙に変化し、病気のかかりやすさや医薬品への反応に変化が生じるのである。この違いを把握していくことで、将来的なオーダーメイド医療などにつながっていくというわけだ。
これらのSNPを、別のAIS患者786人と対照者2万4466人からなる日本人集団について調べたところ、6番染色体上の1つのSNPでその相関が再現された。2つの集団の結果を統合すると、最も強い相関を示すSNP「rs6570507」のP値は2.25×10-10になり、日本人ではこのSNPを持つと発症のリスクが1.28倍高まることが判明したのである(画像2)。
画像2の表は、AISの段階的相関解析で発見されたrs6570507の相関を表したものだ。表の見方だが、P値は相関の強さの指標を表し、Cochran-Armitage trend testによる。この値が低いほど、相関が高いと判定できる。オッズ比は、相関の大きさ、リスク多型の影響力の指標を表す。リスク多型を1つ持つごとにAIS発症リスクが1.27倍に高まる。項目「集団」にある「統合」とは、GWASと再現解析の結果を「Mantel-Haenzel法」によるメタ解析で統合したものだ。
さらにAIS患者743人と対照1209人からなる中国人集団、およびAIS患者447人と対照737人からなる欧米人集団についての調査も行われ、どちらの集団でもこのSNPの相関が再現された。従って、このSNPが複数の人種においてAIS発症に関与することがわかったのである。
ゲノム上のrs6570507の位置を調べて見ると、「GPR126遺伝子」の「イントロン」(必要とされていない部分、逆に必要とされる部分は「エクソン」)内に存在していた。さらに、GPR126遺伝子領域内を網羅的に解析したところ、rs6570507とほぼ「完全連鎖」するSNPが18個存在し、rs6570507と同程度の強い相関を示すことがわかった。完全連鎖とは、2つのSNPがゲノム上で極度に近接しているとその間での組換え確率が低くなり、見かけ上2つのSNPが常に1組となって遺伝する状態のことをいう。つまり、rs6570507を含む19個のSNPがAISと関連している可能性が高いとしている。
さらに、研究チームがAISの病変部であるヒトの軟骨や骨、椎間板でのGPR126の発現パターンが調べられたところ、軟骨組織で高く発現していることがわかった。GPR126はヒトの身長や体幹の長さにも関与する遺伝子として知られており、GPR126の機能を欠失させたマウスでは成長障害が見られることが報告されている。
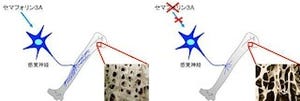
さらに、京大の宿南準教授らとも共同研究が行われ、GPR126はマウスの脊椎の「成長軟骨板」の増殖軟骨細胞層に発現すること、GPR126の発現を抑制させたゼブラフィッシュでは、椎骨の骨化が遅延し、体長が小さくなることが判明した(画像2・3)。よって、GPR126の異常は軟骨の形成の障害を通じてAIS発症に関与すると考えられるという。
今回の研究から、複数の人種においてAISに関連する遺伝子が発見された。この発見により、AISの原因や病態の解明、オーダーメイド医療に向けての新たな展開が急速に進展することが期待できるという。ちなみに稲葉研究員らは、前回報告したLBX1と共に相関解析によるゲノム情報と臨床情報を統合したAISの診断・予測モデルの作成に着手しているとしており、これにより、AISの発症・進行のリスクがより簡便で正確、かつ確実に予測できるようになるとしている。
また今回の結果は、GPR126の異常が軟骨の形成障害を引き起こし、それによってAISが発症することを示唆するとしたほか、GPR126は神経細胞の軸索を覆う「髄鞘」の形成にも重要であることが知られており、神経系がAIS発症に関連する可能性もあるという。今後、GPR126の機能解析やAIS発症に関わる新たな経路をさらに詳しく調べることで、分子レベルにおいてAISの病態の理解が進み、新しいタイプのAIS治療薬の開発が可能になることが期待できると、研究チームは語っている。