東京大学は5月2日、多能性幹細胞(マウスES細胞およびヒトiPS細胞)から「オレキシン神経細胞」を作り出すことに成功したと発表した。
成果は、東大大学院 農学生命科学研究科 応用動物科学専攻の早川晃司特任助教、同・塩田邦郎教授らの研究チームによるもの。研究の詳細な内容は、4月26日付けで米国学術誌「Journal of Biological Chemistry」にオンライン掲載された。
山中伸弥教授がノーベル賞を受賞したこともあり、現在、iPS細胞やES細胞などの多能性幹細胞に関する研究が世界中でますます活発になっている。多能性幹細胞からさまざまな細胞への分化誘導に関する研究が行われているが、創薬や再生医療を目的としたさまざまな神経細胞の作出もその1つだ。
今回、研究チームが作出に挑んだオレキシン神経細胞は、睡眠・覚醒および摂食行動の制御をコントロールしている神経ペプチドのオレキシンを産生する神経細胞のことである。オレキシン神経細胞はさまざまな疾病や老化に伴い減少することが知られているが、オレキシン神経細胞がどのようにできるのかはこれまでのところわかっていない。当然ながら、これまで作出に成功した例もなかったのである。
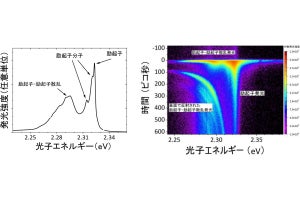
実験では、マウスES細胞から神経細胞を作る際に、糖代謝中間体を加えて観察が行われた。その結果、中間体の1つである「N-アセチルマンノサミン(ManNAc)」を添加すると、オレキシンを作る「Hcrt遺伝子」が発現することが明らかになった。
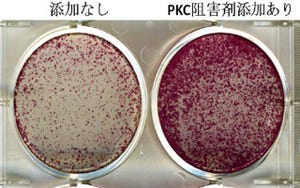
従来の培養方法で作った神経細胞では、Hcrt遺伝子の制御部分にはさまざまな抑制性の因子であるヒストン脱アセチル化酵素「Sirt1」や糖転移酵素「Ogt」などが結合しており、その結果、DNAが「メチル化」され遺伝子を利用できない状態、つまり眠った状況にあることがわかった。
ほ乳類ではDNAを構成するアデニン(A)、グアニン(G)、シトシン(C)、チミン(T)の4種類の塩基の内、主にCG配列のCにのみ酵素によってメチル基が付加され、このことをメチル化という。DNAはタンパク質「ヒストン」に巻き付いて染色体を形成した形で核の中に収められているが、DNAがメチル化されると、構造が凝縮し、そのDNAの領域に遺伝子(ここでいう遺伝子とは、ゲノム全体を指すのではなく、タンパク質を作り出すなど有用な設計図の一部を指す)が存在していても利用できなくなるのである。
一方、ManNAcが加えられたところ、DNAの脱メチル化が進行。ヒストンの「アセチル化」を促進することで、Hcrt遺伝子が利用できる状況に至ることが確かめられた。ヒストンはさまざまな分子に修飾されるが、アセチル化もその1つで、アセチル化がなされると遺伝子が使える状態(活性化)となる。
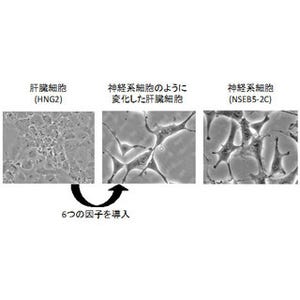
この時、Hcrt遺伝子の制御部位に結合していたSirt1やOgtなど抑制性因子は、「Mgea5」などの促進性因子に置き換わり、ヒストンがアセチル化されていることが確認された。このようにして作られた神経細胞は脳内のオレキシン神経細胞で見られるほかのマーカー遺伝子も発現しており、またオレキシンを分泌する能力もあり、その分泌はほかの神経ペプチドである「レプチン」や「グレリン」などに反応することも明らかになったため、今回作出された神経細胞はオレキシン神経細胞であることが確認されたというわけだ。
さらに、細胞の分化にはエピジェネティクス状況を変えることが必要になるが、ManNAcにはエピジェネティクス機構に働きかけオレキシン神経細胞を誘導する働きがあることも今回の研究から明らかになったという。
エピジェネティクスとは「DNAの塩基配列の変化を伴わずに細胞分裂後も伝達される遺伝子機能の変化について探求する学問領域」を意味し、同じゲノムを持ちながら種類が異なる細胞の間でなぜ遺伝子発現(つまり形質)が違うのかを研究するものである。
今回の研究で重要なポイントとなったDNAのメチル化とヒストン修飾は、まさにエピジェネティクス制御の中心だ。その2つの組み合わせで、DNAとヒストンが巻き付いた(クロマチン)構造が変化し、細胞の固有の遺伝子発現パターンが固定化される仕組みとなっているのである。
今回オレキシン神経細胞を作出することに成功し、この神経細胞への分化のメカニズムが明らかになった形だ。研究チームは、この成果により、食欲改善、睡眠障害、モチベーションの回復といった治療薬の開発、再生医療への道が開けたとコメントしている。