東京大学医科学研究所(東大医科研)は4月26日、大阪大学(阪大)、米コロンビア大学との共同研究により、腸管での生体防御を担う抗体「IgA」を高産生する新しい細胞サブセットを同定したと発表した。
成果は、東大医科研の國澤純客員教授(医薬基盤研究所 プロジェクトリーダー兼任)、同・清野宏教授、阪大 免疫学フロンティア研究センターの審良静男教授、阪大大学院 医学系研究科の竹田潔教授、コロンビア大のIvaylo Ivanov助教らの国際共同研究チームによるもの。研究の詳細な内容は、英国科学雑誌「Nature Communications」に掲載される予定だ。
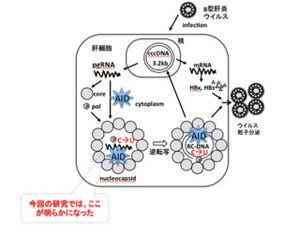
飲むワクチンである「経口ワクチン」が、日本においても実用化の段階になってきた。その経口ワクチンにおいて生体防御の中核を担うのがIgA抗体だ。腸管組織で産生されたIgAは管腔に分泌された後、病原体や毒素に結合することで感染症の発症を防ぐ仕組みを持つ。この腸管組織におけるIgAの産生には腸内細菌からの刺激が重要であることが知られていたが、その実体については未解明な点が多く残されていたのである。
研究チームは今回、まず常在細菌を持たない無菌マウスや抗生物質で処理したマウスと通常飼育したマウスの腸管の細胞を回収し、フローサイトメトリー法を用いてIgAと「CD11b分子」の発現の比較が行われた。通常マウスの腸管においては、IgA抗体産生細胞はCD11bの発現により陽性細胞と陰性細胞の2つに分類される。比較の結果、無菌マウスや抗生物質処理マウスではCD11b陽性細胞が優性的に減少していることが確認された(画像1)。
また、自然免疫に関わる受容体の主要アダプター分子である「MyD88」や腸管における免疫誘導組織の1つである「パイエル板」を欠損したマウスにおいても、CD11b陽性IgA産生細胞が減少していることが判明。それらのことから、CD11b陽性IgA産生細胞は常在細菌由来のシグナルをMyD88依存的に受け取り、かつパイエル板依存的に誘導されるサブセットであることがわかったというわけだ。
次に、CD11b陽性IgA産生細胞の特異性を解明するために、各細胞の形態や細胞表面での分化マーカーの発現を比較。するとCD11bの発現に関わらず、腸管に存在するIgA産生細胞は、すべてこれまで形質細胞として分類されていた表現型を示すことが確認された。
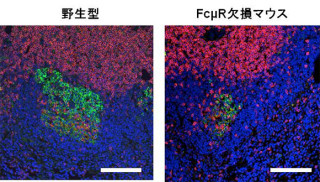
そこで、次に各細胞の特異性を解明するためにマイクロアレイ解析を実施。CD11b陰性細胞に比べ。CD11b陽性IgA産生細胞は細胞周期に関わる分子の発現が高く、また生体内においても細胞増殖活性が高いことを示す結果が得られたのである(画像2・3)。
さらに機能的な解析として、経口ワクチンによるIgA抗体の産生誘導におけるCD11b陽性IgA産生細胞の役割の解析も行われた。すると、CD11b陽性IgA産生細胞を優先的に除去したマウスにおいては、経口ワクチン投与1週間後に観察されるワクチン抗原特異的IgA抗体の産生が著しく減少していることが確認されたのである(画像3)。さらに、CD11b陽性IgA産生細胞はCD11b陰性サブセットに比べ、IgA抗体の産生能力が高いことも判明した。
|
|
|
画像4。モデル抗原としてコレラ菌が産生する毒素「コレラトキシン」を週1回計3回の頻度で経口免疫した後、CD11b陽性IgA産生細胞に多く含まれる増殖細胞を「サイクロフォスファミド(CPM)」の投与による除去が行われた。その結果、CPM処理群ではコレラトキシンに対するIgA抗体産生がタイターとして約8分の1に減弱した |
研究チームは今回の研究結果に対し、これまで単一の細胞と考えられていた腸管のIgA抗体産生細胞がCD11bの発現と機能により2つに分けられ、経口ワクチンによる初期免疫誘導における機能を担うサブセットが存在することを初めて示したものとした。今後は、ヒトでの解析を含め、経口ワクチンへの応用を見据えた研究へと展開できることが期待されるともコメントしている。